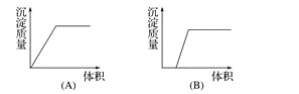
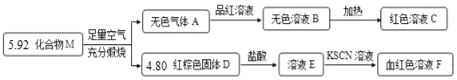
题目内容
【题目】铜冶金术以火法治为主,炼铜的副产品SO2多用于制硫酸和石背等化学产品。火法炼铜的工艺流程如下:

反应I:2Cu2S(s)+3O2(g)→2Cu2O(s)+2SO2(g)+768.2kJ
反应II:2Cu2O(s)+Cu2S(s)→6Cu(s)+SO2(g)-116.0kJ
(1)在反应Ⅱ中,每生成1mol SO2转移电子_______mol,反应Cu2S(s)+O2(g)→2Cu(s)+SO2(g)+Q的Q=_____kJ。
(2)理论上m1:m2=_________。
【答案】6 217.4 2:1
【解析】
(1)在反应Ⅱ中,Cu2O与Cu2S发生氧化还原反应,当生成1mol SO2时,转移6mol电子,故答案为:6;
(2)由已知可知,反应(Ⅰ+Ⅱ)×![]() 可得反应Cu2S(s)+O2(g)→2Cu(s)+SO2(g),则根据盖斯定律可得
可得反应Cu2S(s)+O2(g)→2Cu(s)+SO2(g),则根据盖斯定律可得![]() ,故答案为:217.4;
,故答案为:217.4;
(3)假设反应Ⅰ中加入2mol的Cu2S,那么充分反应生成2mol的Cu2O,在反应II中,2mol的Cu2O只需要消耗1mol的Cu2S,因此两次加入的Cu2S的物质的量之比为2:1,m1:m2=2:1,故答案为:2:1。

【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
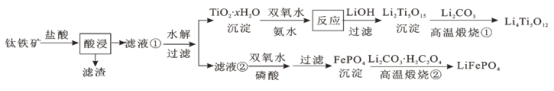
下列说法不正确的是
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl- = Fe2++ TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑
温度/ | 30 | 35 | 40 | 45 | 50 |
TiO2 ·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
D.TiO2 ·xH2O沉淀与双氧水、氨水反应40min所得实验结果如上表所示, 40 oC前,未达到平衡状态,随着温度升高,转化率变大