题目内容
邻苯二甲酸氢钾(KHC8H4O4,相对分子质量204.2)可以用于标定NaOH溶液的浓度,反应如下:KHC8H4O4+NaOH=KnaC8H4O4+H2O 准确称取0.5105 g KHC8H4O4晶体,溶于水后加入酚酞指示剂,用NaOH溶液滴定至溶液呈淡红色,消耗20.00 ml NaOH溶液,计算NaOH溶液的浓度(结果保留四位有效数字).

 阅读快车系列答案
阅读快车系列答案(1)当达到滴定终点时,已知溶液的pH应为9.1左右,现给定甲基橙、酚酞、石蕊三种指示剂,你选择的指示剂是? ?(已知甲基橙、酚酞、石蕊三种指示剂的变色范围分别为3.1~4.4、8.2~10.0、5.0~8.0)。?
(2)某学生的三次实验数据如下:
实验编号 | 取邻苯二甲酸氢钾的质量 | 消耗待测NaOH溶液的体积 |
① |
| (n+0.80)mL |
② |
| g(n+0.10)mL |
③ |
| g(n-0.10)mL |
第一次测定消耗体积较大的原因可能是下列中的 (填序号)。?
①滴定管没有用NaOH溶液润洗,只用了水洗 ②滴定前管尖有气泡,滴定后消失 ③滴定终点把握不准,溶液呈深红色 ④溶液有洒落现象 ⑤滴定终点把握不准,溶液呈粉红色后又马上变为无色 ⑥滴定前俯视读数,滴定后仰视读数?
(3)若m=0.04n,n=17,则c(NaOH)= 。
(12分)实验室常用准确称量的邻苯二甲酸氢钾(结构简式如图所示)来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法。
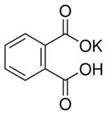
已知:①NaOH溶液的浓度在0.1 mol·L-1左右,滴定终点时溶液的pH应为9.1。
②邻苯二甲酸氢钾相对分子质量为204
(1)写出邻苯二甲酸氢钾与NaOH反应的离子方程式________________________。
(2)将用托盘天平称好的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液呈无色,
再加入指示剂______(从甲基橙、酚酞中选择),用NaOH溶液滴定到终点时,现象是____________。
某学生进行了四次实验,实验数据如下表:
|
实验编号 |
邻苯二甲酸氢钾的质量(g) |
待测NaOH溶液的体积(mL) |
|
1 |
0.4080 |
18.20 |
|
2 |
17.10 |
|
|
3 |
16.90 |
|
|
4 |
17.00 |
(3)滴定中误差较大的是第________次实验,造成这种误差的可能原因是____________。
A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.盛有邻苯二甲酸氢钾溶液的锥形瓶中有少量水
D.达到滴定终点时,俯视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
F.滴定到终点时,溶液颜色由无色变到了红色
(4)该同学所测得的NaOH溶液的物质的量浓度为________ mol·L-1(结果保留三位小数)。

 ,相对分子质量为204.0)是常用的基准物质.某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度.在本实验中达到滴定终点时,溶液的pH约为9.1.
,相对分子质量为204.0)是常用的基准物质.某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度.在本实验中达到滴定终点时,溶液的pH约为9.1. 某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1.
某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1.