题目内容
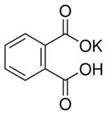
(12分)实验室常用准确称量的邻苯二甲酸氢钾(结构简式如图所示)来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法。
已知:①NaOH溶液的浓度在0.1 mol·L-1左右,滴定终点时溶液的pH应为9.1。
②邻苯二甲酸氢钾相对分子质量为204
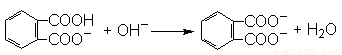
(1)写出邻苯二甲酸氢钾与NaOH反应的离子方程式________________________。
(2)将用托盘天平称好的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液呈无色,
再加入指示剂______(从甲基橙、酚酞中选择),用NaOH溶液滴定到终点时,现象是____________。
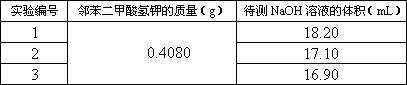
某学生进行了四次实验,实验数据如下表:
|
实验编号 |
邻苯二甲酸氢钾的质量(g) |
待测NaOH溶液的体积(mL) |
|
1 |
0.4080 |
18.20 |
|
2 |
17.10 |
|
|
3 |
16.90 |
|
|
4 |
17.00 |
(3)滴定中误差较大的是第________次实验,造成这种误差的可能原因是____________。
A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.盛有邻苯二甲酸氢钾溶液的锥形瓶中有少量水
D.达到滴定终点时,俯视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
F.滴定到终点时,溶液颜色由无色变到了红色
(4)该同学所测得的NaOH溶液的物质的量浓度为________ mol·L-1(结果保留三位小数)。
(1)
 (2分)
(2分)
(2)酚酞 (2分) 溶液颜色由无色突变到粉红色且半分钟内不再变色(2分)
(3)1 (1分) A、B、F (3分,各1分,多选倒扣,扣完为止)(4)0.118(2分)
【解析】(1)滴定终点时溶液的pH应为9.1,即溶液显碱性,所以邻苯二甲酸氢钾是弱酸的酸式盐,因此离子方程式为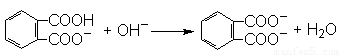
(2)由于终点时溶液显碱性,因此应该选择酚酞,现象是溶液颜色由无色突变到粉红色且半分钟内不再变色。
(3)根据消耗的氢氧化钠溶液体积可知,实验1的误差较大。A中氢氧化钠被稀释,所以消耗的体积就偏多,A正确;B中相当于消耗的氢氧化钠溶液体积增加,正确;锥形瓶中含有蒸馏水,不影响结果;俯视读数,读数偏小,结果偏低;液滴飞溅出来导致溶质减少,消耗的碱液体积减少;溶液颜色由无色变到了红色,说明氢氧化钠加多了,因此答案选ABF。
(4)后三次实验中氢氧化钠溶液体积的平均值是17.00ml,邻苯二甲酸氢钾是0.002mol,所以根据方程式可知氢氧化钠的物质的量也是0.002mol,所以浓度是0.002mol÷0.017L=0.118mol/L。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
| |||||||||||||||||||
| |||||||||||||||||||
(12分)实验室常用准确称量的邻苯二甲酸氢钾(结构简式如图所示)来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法。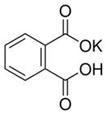
已知:①NaOH溶液的浓度在0.1 mol·L-1左右,滴定终点时溶液的pH应为9.1。
②邻苯二甲酸氢钾相对分子质量为204
(1)写出邻苯二甲酸氢钾与NaOH反应的离子方程式________________________。
(2)将用托盘天平称好的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液呈无色,
再加入指示剂______(从甲基橙、酚酞中选择),用NaOH溶液滴定到终点时,现象是____________。
某学生进行了四次实验,实验数据如下表:
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4080 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 | |
| 4 | 17.00 |
A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.盛有邻苯二甲酸氢钾溶液的锥形瓶中有少量水
D.达到滴定终点时,俯视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
F.滴定到终点时,溶液颜色由无色变到了红色
(4)该同学所测得的NaOH溶液的物质的量浓度为________ mol·L-1(结果保留三位小数)。
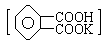 来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法.从资料查得,滴定终点的pH应为9.1.试回答:
来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法.从资料查得,滴定终点的pH应为9.1.试回答: