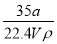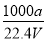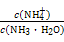题目内容
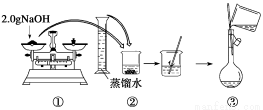
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥为原料制取MgSO4·7H2O的实验过程如下:
―→―→产品
已知:①室温下Ksp[Mg(OH)2]=6.0×10-12。②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7。③三种化合物的溶解度(S)随温度变化的曲线如图所示。

(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是_____________________。
(2)若室温下的溶液中Mg2+的浓度为6.0 mol·L-1,则溶液pH≥________才可能产生Mg(OH)2沉淀。
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是__________________,滤渣的主要成分是______________________。
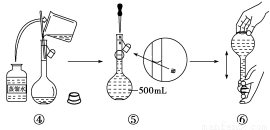
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入______________;②过滤,得沉淀;③________________;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O的质量为24.6 g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为________(MgSO4·7H2O的相对分子质量为246)。
(1)提高Mg2+的浸取率(其他合理答案均可)
(2)8
(3)温度较高时钙盐与镁盐分离得更彻底(或高温下CaSO4·2H2O溶解度小等合理答案均可) Al(OH)3、Fe(OH)3、CaSO4·2H2O
(4)NaOH溶液 向沉淀中加足量稀硫酸(合理答案均可)
(5)20.0%
【解析】(1)加入H2SO4可以使Mg的硅酸盐或碳酸盐充分转化成Mg2+。(2)c(OH-)=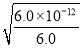 mol·L-1=10-6 mol·L-1,所以pH=8。(3)加入NaClO,可以把Fe2+氧化成Fe3+,当pH大约为5时,Fe3+、Al3+转化成沉淀;根据溶解度曲线,温度高时,CaSO4·2H2O的溶解度更小,所以滤渣的主要成分为Al(OH)3、Fe(OH)3和CaSO4·2H2O。(4)使Mg2+转化成MgSO4·7H2O的步骤为①加入NaOH溶液。②过滤得Mg(OH)2沉淀。③加入稀H2SO4。④蒸发浓缩、降温结晶、过滤得产品。(5)根据镁元素守恒得
mol·L-1=10-6 mol·L-1,所以pH=8。(3)加入NaClO,可以把Fe2+氧化成Fe3+,当pH大约为5时,Fe3+、Al3+转化成沉淀;根据溶解度曲线,温度高时,CaSO4·2H2O的溶解度更小,所以滤渣的主要成分为Al(OH)3、Fe(OH)3和CaSO4·2H2O。(4)使Mg2+转化成MgSO4·7H2O的步骤为①加入NaOH溶液。②过滤得Mg(OH)2沉淀。③加入稀H2SO4。④蒸发浓缩、降温结晶、过滤得产品。(5)根据镁元素守恒得 ×100%=20%。
×100%=20%。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
① |
| FeCl2 | FeCl3 | Fe | CuCl2 |
② | NO | NO2 | N2 | HNO3 | |
③ | Na2O | Na2O2 | Na | NaOH | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A.①④ B.①②③ C.①③④ D.②④
一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:
2SO2(g)+O2(g)  2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1s的平均速率v(O2)=0.4/t1 mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大