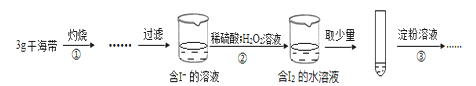
题目内容
【题目】对于下列氧化还原反应,请按要求填空。
Cu + 4HNO3(浓)=== Cu(NO3)2+ 2NO2↑ + 2H2O
①用双线桥法标出电子转移的方向和数目_____________;
②氧化剂________,氧化产物__________;
③被还原的HNO3与参加反应的HNO3物质的量之比是_______;若有1molCu被氧化,则被还原的硝酸质量为 _____ g;若参加反应的硝酸为1.6mol,则放出气体的体积(在标准状况下)为___L;
④离子方程式:_______。
【答案】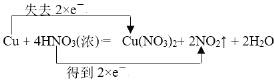 HNO3 Cu(NO3)2 1:2 126 17.92 Cu+4H++2NO3- = Cu2++2NO2↑+2H2O;
HNO3 Cu(NO3)2 1:2 126 17.92 Cu+4H++2NO3- = Cu2++2NO2↑+2H2O;
【解析】
根据铜元素的化合价升高,硝酸中氮元素的化合价降低,来画双线桥,根据氧化还原反应的概念分析氧化剂和氧化产物,利用化合价降低来分析被还原的物质的物质的量,根据方程式进行计算。
①铜元素的化合价升高,硝酸中氮元素的化合价降低,双线桥法标出电子转移的方向和数目 ;故答案为:
;故答案为:
②所含元素的化合价降低的物质是氧化剂,硝酸中氮元素的化合价降低,因此氧化剂为HNO3;化合价升高得到的产物为氧化产物,Cu元素的化合价升高后得到Cu(NO3)2,因此氧化产物是Cu(NO3)2;故答案为;HNO3;Cu(NO3)2。
③4mol硝酸参与反应,其中有2mol硝酸被还原,因此被还原的HNO3与参加反应的HNO3物质的量之比是2:4 = 1:2;若有1molCu被氧化,则被还原的硝酸物质的量为2mol,被还原的硝酸质量为2 mol ×63 gmol1=126 g;根据化学方程式4mol硝酸反应生成2mol气体,若参加反应的硝酸为1.6mol,则生成的气体物质的量为![]() ,放出气体的体积(在标准状况下)为0.8mol ×22.4 L·mol1= 17.92L;故答案为:1:2;126;17.92。
,放出气体的体积(在标准状况下)为0.8mol ×22.4 L·mol1= 17.92L;故答案为:1:2;126;17.92。
④硝酸是强酸,硝酸铜是易溶于水的盐,因此该反应的离子方程式为Cu+4H++2NO3- = Cu2++2NO2↑+2H2O;故答案为:Cu+4H++2NO3- = Cu2++ 2NO2↑+ 2H2O。