题目内容
下表为周期表的一部分,其中的编号代表对应位置的元素。
请回答下列问题:
(1)写出上表中元素⑨原子的核外电子排布式 。
(2)元素④、⑤的第一电离能大小顺序是: > ;(用元素符号表示,下同)元素⑥、⑧电负性大小顺序是: >
(3)元素③、⑧形成的化合物中心原子杂化轨道类型: ,分子的空间构型
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢
氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的化学方程式
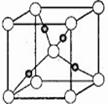
(5)下图是⑩的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为 。
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。
已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是:
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | ⑥ | |
| | | | | | | | | | | | | ⑦ | | | | ⑧ | |
| | | | | | ⑨ | | | | | ⑩ | | | | | | | |
(1)写出上表中元素⑨原子的核外电子排布式 。
(2)元素④、⑤的第一电离能大小顺序是: > ;(用元素符号表示,下同)元素⑥、⑧电负性大小顺序是: >
(3)元素③、⑧形成的化合物中心原子杂化轨道类型: ,分子的空间构型
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢
氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的化学方程式
(5)下图是⑩的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为 。

(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。
已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是:
(共16分 每空各2分)
(1)1S22S22P63S23P63d 54s1(2)N>O ;F>Cl(3)sp3杂化;正四面体型
(4)Be(OH)2+2NaOH===2H2O+Na2BeO2 (5)Cu2O
(6)NF3分子中氟原子电负性强,吸引电子能力强,使得氮原子上的孤对电子难于与Cu2+形成配位键。
(1)1S22S22P63S23P63d 54s1(2)N>O ;F>Cl(3)sp3杂化;正四面体型
(4)Be(OH)2+2NaOH===2H2O+Na2BeO2 (5)Cu2O
(6)NF3分子中氟原子电负性强,吸引电子能力强,使得氮原子上的孤对电子难于与Cu2+形成配位键。
(1)⑨是铬元素,根据构造原理可知,其原子核外电子的排布式为1S22S22P63S23P63d 54s1。
(2)④⑤分别是N、O。非金属性越强,第一电离能越大。但由于氮原子的2p轨道电子是半充满状态,稳定性强,所以氮元素的第一电离能大于氧元素的。⑥⑧分别是F和Cl,非金属性越强,电负性越大,氟的非金属性强于Cl的,所以氟的电负性大于氯的。
(3)③⑧形成的CCl4分子中,中心原子的孤对电子是(4-1×4)÷2=0对,所以是正四面体形结构,碳原子是sp3杂化。
(4)②是B,⑦是铝。氢氧化铝是两性氢氧化物,所以根据新制相似可知,反应式为
Be(OH)2+2NaOH===2H2O+Na2BeO2。
(5)⑩是铜。根据晶胞对结构可知,晶胞中含有氧原子是8×1/8+1=2,含有铜原子是4铬,所以化学式为Cu2O。
(6)由于氟原子是最强对非金属元素,因而NF3分子中氟原子电负性强,吸引电子能力强,使得氮原子上的孤对电子难于与Cu2+形成配位键。
(2)④⑤分别是N、O。非金属性越强,第一电离能越大。但由于氮原子的2p轨道电子是半充满状态,稳定性强,所以氮元素的第一电离能大于氧元素的。⑥⑧分别是F和Cl,非金属性越强,电负性越大,氟的非金属性强于Cl的,所以氟的电负性大于氯的。
(3)③⑧形成的CCl4分子中,中心原子的孤对电子是(4-1×4)÷2=0对,所以是正四面体形结构,碳原子是sp3杂化。
(4)②是B,⑦是铝。氢氧化铝是两性氢氧化物,所以根据新制相似可知,反应式为
Be(OH)2+2NaOH===2H2O+Na2BeO2。
(5)⑩是铜。根据晶胞对结构可知,晶胞中含有氧原子是8×1/8+1=2,含有铜原子是4铬,所以化学式为Cu2O。
(6)由于氟原子是最强对非金属元素,因而NF3分子中氟原子电负性强,吸引电子能力强,使得氮原子上的孤对电子难于与Cu2+形成配位键。

练习册系列答案
相关题目
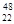 Ti和
Ti和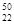 Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;按电子排布Ti元素在元素周期表分区中属于 (填s、p、d、ds或f)区元素
Ti两种原子,它们互称为 。Ti元素在元素周期表中的位置是第 周期,第 族;按电子排布Ti元素在元素周期表分区中属于 (填s、p、d、ds或f)区元素