题目内容
3.人们在认识事物时可以采取多种分类方法,下列关于“Na2CO3”的分类不正确的是( )| A. | 离子化合物 | B. | 电解质 | C. | 钠盐 | D. | 碱性氧化物 |
分析 根据电解质、钠盐、碱性氧化物、离子化合物的定义考虑本题,严格按照定义将碳酸钠进行归类.
解答 解:A、碳酸钠中含有离子键,属于离子化合物,故A不选;
B、碳酸钠是一种在水溶液或是熔融状态下都能导电的化合物,属于电解质,故B不选;
C、碳酸钠电离出的阳离子是钠离子,属于钠盐,故C不选;
D、碱性氧化物是指和酸反应生成盐和水的氧化物,碳酸钠不属于氧化物,当然不是碱性氧化物,属于盐类,故D选.
故选D.
点评 通过回答本题可知同一种盐按照不同的分类标准,它的归类是不同的,所以要严格按照定义去分类.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
相关题目
3.室温下,下列各组粒子在指定溶液中一定能大量共存的是( )
| A. | 在NaNO3和NaCl混合溶液:H+、NH4+、SO42-、Cu2+ | |
| B. | 加入金属镁能产生H2的溶液:Na+、SO42-、Cu2+、NO3- | |
| C. | 常温下由水电离出的c(OH-)=10-12mol/L的溶液:Na+、SO32-、Cl-、Mg2+ | |
| D. | pH=2的溶液中:ClO-、K+、CH2CHO、SO42- |
14.钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有少量MgO、SiO2等杂质.利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图:
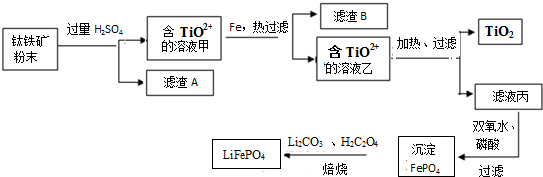
已知:FeTiO3+4H+=Fe2++TiO2++2H2O草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是+2.
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为SiO2(填化学式).
(3)含TiO2+溶液乙转化生成TiO2的离子方程式是TiO2-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H+.
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是20:9.
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为$\frac{cV×10{\;}^{-3}×M}{w}$×100%(用代数式表示).
(6)TiO2制取单质Ti,涉及到的步骤如下:TiO2$\stackrel{①}{→}$TiCl4$→_{Mg_{800}℃}^{②}$Ti
反应②的方程式是TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti,由TiCl4→Ti需要在Ar气中进行的理由是高温下Mg(Ti)会与空气中的O2(或CO2、N2)作用.反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于1412℃即可.

已知:FeTiO3+4H+=Fe2++TiO2++2H2O草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是+2.
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为SiO2(填化学式).
(3)含TiO2+溶液乙转化生成TiO2的离子方程式是TiO2-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H+.
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是20:9.
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为$\frac{cV×10{\;}^{-3}×M}{w}$×100%(用代数式表示).
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
反应②的方程式是TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti,由TiCl4→Ti需要在Ar气中进行的理由是高温下Mg(Ti)会与空气中的O2(或CO2、N2)作用.反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于1412℃即可.
11. 25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
 25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )| A. | Na2S溶液中:c(S2-)+c(HS-)+c(H2S)═2c(Na+) | |
| B. | 25℃时K甲(CuS)约为1×10-35 | |
| C. | 向100mLZn2+、Cu2+浓度均为10-5mol•L-1的混合溶液中逐滴加入10-4mol•L-1的Na2S溶液,Cu2+先沉淀 | |
| D. | 向Cu2+浓度为10-5mol•L-1的工业废水中加入ZnS粉末,会有CuS沉淀析出 |
18.已知三种元素,其原子最外层电子数之和为17,核内质子数之和为31,满足上述条件的一组元素是( )
| A. | N P Cl | B. | P O S | C. | N O S | D. | O P Cl |
8.能制得括号中纯净物的是( )
| A. | 等物质的量的乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 氯气与乙烷在光照下反应(氯乙烷) | |
| C. | 苯与硝酸在浓硫酸、加热条件下反应(硝基苯) | |
| D. | 乙醇、乙酸与浓H2SO4混合加热(乙酸乙酯) |
15.某短周期主族元素R的最高化合价与负化合价代数和为4.则下列叙述中正确的是( )
| A. | R是第ⅣA族元素 | B. | R能形成两种氧化物RO2和RO3 | ||
| C. | R的气态氢化物的化学式RH4 | D. | R的气态氢化物的水溶液显强酸性 |
12.按图示装置,实验能够成功的是( )


| A. | 装置用于检验溴丙烷消去产物 | B. | 装置用于测定乙醇的结构式 | ||
| C. | 装置用于提取I2的CCl4溶液中的I2 | D. | 装置用于除去甲烷中的乙烯 |