题目内容
元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
| A.同周期的主族元素中,ⅦA族元素的原子半径最小 |
| B.碳族元素都是非金属元素,其非金属性随核电荷数的增加而减弱 |
| C.元素周期表中从ⅢB到ⅡB十个纵列的元素都是金属元素 |
| D.ⅠA元素的原子,其半径越大,越容易失去电子 |
B
解析试题分析:A.同周期的主族元素中,从左到右,随着原子序数的增大,原子半径逐渐减小。因此第ⅦA族元素的原子半径最小 。正确。B.同一主族的元素,从上到下,随着原子核外电子层数的增加,元素的金属性逐渐增强,非金属性逐渐减弱。碳族元素的C、Si是非金属元素,Ge、Sn、Pb是金属元素。错误。C.元素周期表中从ⅢB到ⅡB十个纵列的元素都是属于过渡元素,都是金属元素。正确。D.Ⅰ A元素的原子,从上到下。属于核外的电子层数逐渐增多,半径逐渐增大,原子失去电子的能力逐渐增强。即越容易失去电子。正确。
考点:考查同周期、同一主族的元素的原子半径、元素的金属性、非金属性的递变规律的知识。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
| W | X | |
| | Y | Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性强于Y
D.Z元素单质在化学反应中只表现氧化性
下列排序正确的是
| A.酸性:H3AsO4> H2SO4>H3PO4 | B.碱性:Ba(OH)2<Ca(OH)2<KOH |
| C.熔点:MgBr2<SiCl4<SiC | D.沸点:PH3<NH3<H2O |
下列有关化学用语使用正确的是( )
A.硫原子的原子结构示意图: |
B.NH4Cl的电子式: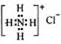 |
C.原子核内有10个中子的氧原子: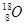 |
| D.纯碱的化学式为NaOH |
下列离子中,所带电荷数与该离子的核外电子层数相等的是( )
| A.Al3+ | B.Mg2+ | C.Be2+ | D.H+ |
元素X的最高正价和负价的绝对值之差为6,元素Y原子次外层与元素X原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是( )
| A.MgF2 | B.MgCl2 | C.CaCl2 | D.CaBr2 |
下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径 | 0.160 nm | 0.143 nm | 0.112 nm | 0.104 nm | 0.066 nm |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.气态氢化物的稳定性为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等