题目内容
【题目】已知某“84 消毒液” 瓶体部分标签如图所示,该“84 消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:

(1)该“84 消毒液” 的物质的量浓度约为________mol·L-1(计算结果保留 2 位有效数字)。
(2)某同学取 100 mL 该“84 消毒液” ,稀释后用于消毒,稀释后的溶液中 c(Na+)=____mol·L-1。
(3)该同学参阅该“84 消毒液” 的配方,欲用 NaClO 固体配制 480 mL 含 NaClO 质量分数为 25%的消毒液。下列说法正确的是______(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B. 将称量好的 NaClO 固体在烧杯中溶解后应立即转入容量瓶并加水至刻度线
C. 定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量 NaClO 固体的质量为 143.0 g

(4)该同学对容量瓶及其使用方法的认识中正确的是(_______)
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后, 需要烘干后再使用
C. 配制溶液过程中,容量瓶内液体只需要一次摇匀过程
D.使用前要检查容量瓶是否漏水
(5) “84 消毒液” 与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为 1.84 g·cm-3)的浓硫酸配制 2 L 2.3 mol·L-1的稀硫酸用于增强“84 消毒液”的消毒能力。
①所配制的稀硫酸中, H+的物质的量浓度为_______mol·L-1。
②需用浓硫酸的体积为_______mL。
(6) “84 消毒液” 如果不慎与“洁厕灵” (主要成分是盐酸)会产生有毒气体氯气。请写出发生反应的离子方程式:_______。
【答案】 4.0 0.04 C D 4.6 250 ClO—+Cl—+2H+=Cl2↑+H2O
【解析】本题主要考查关于物质的量浓度的计算。
(1)该“84 消毒液”的物质的量浓度为c= =
=![]() =4.0mol·L-1。
=4.0mol·L-1。
(2)该“84 消毒液”稀释100倍,稀释后的溶液中c(Na+)成为原来的1/100为0.04mol·L-1。
(3)A.烧瓶、分液漏斗这两种仪器是不需要的,故A错误;B.将称量好的NaClO固体在烧杯中溶解后,等温度恢复至室温时转入容量瓶并加水至刻度线,故B错误;C.定容时俯视容量瓶刻度线,使得所配溶液体积变小,会导致所配溶液浓度偏高,故C正确;D.需要称量NaClO固体的质量为480mL×1.19g/mL×25%=142.8g,故D错误。故选C。
(4)A.容量瓶上不会标有浓度,故A错误;B.容量瓶用蒸馏水洗净后,不需要烘干后再使用,故B错误;C.配制溶液过程中,容量瓶内液体还需要在定容前晃动容量瓶使溶液混合均匀,故C错误;D.使用前要检查容量瓶是否漏水,故D正确。故选D。
(5)①所配制的稀硫酸中,H+的物质的量浓度为硫酸的两倍为4.6mol·L-1。
②c浓=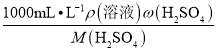 =
=![]() =18.4mol/L,c浓V浓= c稀V稀,需用浓硫酸的体积为V浓=(2.3×2/18.4×1000)mL=250mL。
=18.4mol/L,c浓V浓= c稀V稀,需用浓硫酸的体积为V浓=(2.3×2/18.4×1000)mL=250mL。
(6) “84 消毒液” 如果不慎与“洁厕灵” (主要成分是盐酸)会产生有毒气体氯气。发生反应的离子方程式:ClO-+Cl-+2H+=Cl2↑+H2O.