题目内容
2. 阅读下文,回答问题.
阅读下文,回答问题.甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分,世界20%的能源需求由它提供.
甲烷是重要的工业原料.甲烷高温分解可得炭黑,常用作颜料、油墨、油漆以及橡胶的添加剂;甲烷还是乙炔、氢氰酸及甲醛等重要物质制备的原料;甲烷还可以制取氯仿(三氯甲烷)和四氯化碳等有机溶剂.
天然气中除甲烷外,另有少量的乙烷、丙烷和丁烷,还有硫化氢、二氧化碳、氮气、水汽和少量一氧化碳等.丙烷俗称“高能气”,2008年北京奥运祥云火炬就是用丙烷作为燃料的.丙烷价格低廉,可燃温度范围宽,燃烧火焰呈亮黄色易识别,燃烧产物无污染.它是一种清洁燃料,特别符合“绿色奥运”的理念.天然气中另一种成分丁烷也有重要用途,可用作冷冻剂和气体打火机燃料,也是制取多种有机物的重要原料.
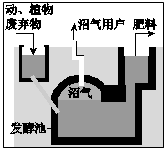
目前沼气在我国农村也有着广泛的应用.人们在一定的温度、湿度、pH条件下,将秸秆、杂草、人畜粪便等堆积在发酵池中,经隔绝空气发酵产生沼气.现在我国农村通过修建沼气池,不但增加了高效清洁燃料,改善了农村居住环境,而且发酵池中还可以产生优良的液体肥料,一举多得.
(1)天然气中除含甲烷外,还含有乙烷、丙烷、丁烷等有机物.
(2)甲烷高温分解得到炭黑的化学方程式是CH4$\stackrel{高温}{→}$ C+2H2.
(3)氯仿的结构式是
 .
.(4)北京奥运火炬选择丙烷作气体燃料的原因是abcd(填序号).
a.可燃温度范围宽 b.价格低廉
c.燃烧产物没有污染 d.燃烧的火焰颜色易识别
(5)乙烷与氯气生成一氯乙烷的化学方程式是CH3CH3+Cl2 $\stackrel{光照}{→}$ CH3CH2Cl+HCl.
(6)下列说法正确的是abd(填序号).
a.煤矿坑道中严禁明火
b.丁烷可作气体打火机的燃料
c.发酵池中只产生沼气
d.发酵池中可利用的原料有秸秆、杂草、人畜粪便等.
分析 (1)阅读题干回答问题,常温下烷烃含4个碳为气体;
(2)甲烷高温分解得到炭黑和氢气,结合原子守恒书写化学方程式;
(3)结合甲烷结构为正四面体分析,三氯甲烷为四面体结构;
(4)丙烷化学符号为C3H8,是无色气体,纯品无臭.燃烧的火焰颜色为亮黄色,在强光和日光情况下均可识别和拍摄,燃烧产物为二氧化碳和水(蒸气);
(5)乙烷与氯气生成一氯乙烷发生取代反应;
(6)a.煤矿坑道中有易燃气体;
b.丁烷在加压条件下为液体,减压变化为常温下的气体;
c.发酵池中主要产生沼气;
d.人们在一定的温度、湿度、pH条件下,将秸秆、杂草、人畜粪便等堆积在发酵池中,经隔绝空气发酵产生沼气.
解答 解:(1)天然气中除甲烷外,另有少量的乙烷、丙烷和丁烷,还有硫化氢、二氧化碳、氮气、水汽和少量一氧化碳等,天然气中除含甲烷外,还含有乙烷、丙烷、丁烷等有机物,
故答案为:乙烷、丙烷、丁烷;
(2)甲烷高温分解得到炭黑的化学方程式是:CH4$\stackrel{高温}{→}$ C+2H2,
故答案为:CH4$\stackrel{高温}{→}$ C+2H2;
(3)氯仿的结构式是: ,故答案为:
,故答案为: ;
;
(4)北京奥运火炬选择丙烷作气体燃料的原因是:丙烷价格低廉,可燃温度范围宽,燃烧火焰呈亮黄色易识别,燃烧产物无污染.它是一种清洁燃料等,故选abcd,
故答案为:abcd;
(5)乙烷与氯气生成一氯乙烷发生取代反应生成氯化氢和一氯乙烷,反应的化学方程式为:CH3CH3+Cl2 $\stackrel{光照}{→}$ CH3CH2Cl+HCl,
故答案为:CH3CH3+Cl2 $\stackrel{光照}{→}$ CH3CH2Cl+HCl;
(6)a.煤矿坑道中有易燃气体,遇到明火发生爆炸,需要严禁明火,故a正确;
b.丁烷在加压条件下为液体,减压变化为常温下的气体,可用作冷冻剂和气体打火机燃料,故b正确;
c.发酵池中主要成分产生沼气,还伴随有其他气体生成,故C错误;
d.人们在一定的温度、湿度、pH条件下,将秸秆、杂草、人畜粪便等堆积在发酵池中,经隔绝空气发酵产生沼气,发酵池中可利用的原料有秸秆、杂草、人畜粪便等,故d正确;
故答案为:abd.
点评 本题考查了沼气的生成和成分、烷烃性质分析判断、主要是题干信息的利用,掌握基础是解题关键,题目难度不大.

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
| A. | HCl和CO2 | B. | NH3 和CH4 | C. | SO2 和CO | D. | NO和NO2 |
| A. | $\frac{w(A+x-n)}{A}$mol | B. | $\frac{A(A-x+n)}{w}$mol | C. | $\frac{w(A-x-n)}{A}$mol | D. | $\frac{w(A+x+n)}{A}$mol |
| A. | a=2,b=1 | B. | a=3,b=2 | C. | a=2,b=2 | D. | a=3,b=3 |
| A. | 从石油中分馏出汽油 | B. | 煤的气化制水煤气 | ||
| C. | 煤的干馏制焦炭 | D. | 油脂的水解制肥皂 |

(1)MgCO3溶于稀硫酸的离子方程式是MgCO3+2H+═Mg2++CO2↑+H2O.
(2)加入H2O2溶液的目的是H2O2+2Fe2++2H+═2Fe3++2H2O(用离子方程式表示).
(3)已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Mg2+ | Fe2+ | Fe3+ |
| 开始沉淀 | 9.1 | 7.6 | 1.9 |
| 完全沉淀 | 11.1 | 9.7 | 3.2 |
(4)“过滤”所得滤液中存在大量的阳离子有Mg2+、NH4+.
(5)“结晶”步骤中需蒸发浓缩滤液,使用的仪器有铁架台、酒精灯和蒸发皿、玻璃棒.
| 有机物A | 有机物B | 有机物C | 有机物D |
| ①可用于果实催熟 ②比例模型为  | ①由C、H两种元素组成 ②球棍模型为  | ①生活中常见的液态有机物,分子中碳原子数与有机物A相同 ②能与Na反应,但不能与NaOH反应 | ①相对分子质量比有机物C大14 ②能由有机物C氧化生成 |
(1)有机物A的分子式为C2H4.
(2)下列有关有机物A、B的说法正确的是b
a.A、B均可使酸性KMnO4溶液褪色
b.A、B分子中所有的原子在同一平面内
c.等质量的A、B完全燃烧,消耗氧气的量相同
d.A、B分子均含有官能团碳碳双键,能发生加成反应
(3)写出有机物C的同分异构体的结构简式CH3OCH3.
(4)在一定条件下,有机物C与有机物D反应能生成具有水果香味的物质E,其化学反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,某次实验中,以5.0gD为原料,制得4.4gE,则D的转化率为60%.
| A. |  图表示0.1molMgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| B. |  图表示用0.1000 mol•LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol•Lˉ1 | |
| C. |  图表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. |  图表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH |

| A. | ①是将煤在空气中加强热使其分解的过程 | |
| B. | 煤中含有苯、甲苯、二甲笨等有机物 | |
| C. | ②是放热的过程 | |
| D. | B为甲醇或乙酸时,原子利用率均达到100% |