题目内容
10.1molX气体跟amolY气体在体积可变的密闲容器中发生如下反应X( g)+aY(g)=bZ(g),反应达到平衡后,测得X的转化率为50%.而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的$\frac{3}{4}$,则a和b的数值可能是( )| A. | a=2,b=1 | B. | a=3,b=2 | C. | a=2,b=2 | D. | a=3,b=3 |
分析 1mol X气体跟a mol Y气体在体积可变的密闭容器中反应,反应达到平衡后,测得X的转化率为50%,则参加反应的X为0.5mol,则:
X(g)+a Y(g)?b Z(g)
起始量(mol):1 a 0
变化量(mol):0.5 0.5a 0.5b
平衡量(mol):0.5 0.5a 0.5b
同温同压下,气体总质量不变,反应前后混合气体的密度之比和气体体积成反比,即和气体物质的量成反比,反应前混合气体的密度是反应后混合气体密度的$\frac{3}{4}$,则反应前气体物质的量是反应后气体物质的量$\frac{4}{3}$,则(1+a):(0.5+0.5a+0.5b)=4:3,以此解答该题.
解答 解:1mol X气体跟a mol Y气体在体积可变的密闭容器中反应,反应达到平衡后,测得X的转化率为50%,则参加反应的X为0.5mol,则:
X(g)+a Y(g)?b Z(g)
起始量(mol):1 a 0
变化量(mol):0.5 0.5a 0.5b
平衡量(mol):0.5 0.5a 0.5b
同温同压下,气体总质量不变,反应前后混合气体的密度之比和气体体积成反比,即和气体物质的量成反比,反应前混合气体的密度是反应后混合气体密度的$\frac{3}{4}$,则反应前气体物质的量是反应后气体物质的量$\frac{4}{3}$,则(1+a):(0.5+0.5a+0.5b)=4:3,
计算得到:2b=a+1;
依据选项中的取值分析判断,a=3,b=2符合计算关系.
故选B.
点评 本题考查了化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算能力,明确同温同压下混合气体密度之比和气体物质的量成反比是计算关键,题目难度中等.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | H2O | B. | HCl溶液 | C. | H2SO4溶液 | D. | NaOH溶液 |
| A. | 用锌与稀硫酸反应制备氢气时,加入少量硫酸铜 | |
| B. | Al与稀硫酸反应制取H2时,改用质量分数为98.3%的浓硫酸 | |
| C. | Fe与稀硫酸反应时,把铁粉改为铁片 | |
| D. | Na与水反应时增大水的用量 |
| A. | CH4、C2H4 | B. | C2H6、C3H6 | C. | CH4、C2H6 | D. | C2H6、C2H2 |
| A. | Cu2S是唯一的还原产物 | |
| B. | 反应中的氧化剂只有CuSO4 | |
| C. | 被氧化与被还原硫元素的质量比为7:3 | |
| D. | 若以该反应为原理设计原电池,电池的正极为石墨棒,负极是吸附有FeS2粉末的多孔石墨电极,电解质溶液为CuSO4溶液 |
 电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法不正确的是( )
电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法不正确的是( )| A. | a极与电源的正极相连 | |
| B. | 产物丙为硫酸溶液 | |
| C. | 离子交换膜d为阳离子交换膜(允许阳离子通过) | |
| D. | a电极反应式为2H++2e-═H2↑ |
 (1)a图中的图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是3.2mL.
(1)a图中的图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是3.2mL.(2)a图中的图II表示50mL滴定管中液画的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)D.
A.是amL B.是(50-a)mL C.一定大于amL D.一定大于(50-a)mL
(3)排去碱式滴定管中气泡的方法应采用如b图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(4)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+
滴定时,1mol (CH2)6N4H+与1mol H+相当,然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A 滴定管内液面的变化 B 锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成红色.
(2)滴定结果如表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
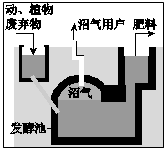 阅读下文,回答问题.
阅读下文,回答问题. .
.