题目内容
对于0.1mol?L-1 NH4Cl溶液,下列说法正确的是( )
| A、溶液中c(Cl-)=c(NH4+)+c(NH3?H2O) |
| B、c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| C、c(NH4+)+c(OH-)=c(Cl-)+c(H+) |
| D、通入少量HCl,c(NH4+)和c(Cl-)均增大 |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:NH4Cl为强酸弱碱盐,水解呈酸性,存在NH4++H2O?NH3?H2O+H+,
A.根据氯化铵溶液中的物料守恒进行判断;
B.铵根离子只是部分水解,铵根离子浓度远远大于氢离子浓度;
C.氯化铵溶液显示碱性,c(H+)>c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可知,c(Cl-)>c(NH4+),则c(NH4+)+c(OH-)<c(Cl-)+c(H+);
D.加入少量氯化氢,溶液中氯离子浓度增大,由于溶液中氢离子浓度增大,抑制了铵根离子的水解,则溶液中铵根离子浓度增大.
A.根据氯化铵溶液中的物料守恒进行判断;
B.铵根离子只是部分水解,铵根离子浓度远远大于氢离子浓度;
C.氯化铵溶液显示碱性,c(H+)>c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可知,c(Cl-)>c(NH4+),则c(NH4+)+c(OH-)<c(Cl-)+c(H+);
D.加入少量氯化氢,溶液中氯离子浓度增大,由于溶液中氢离子浓度增大,抑制了铵根离子的水解,则溶液中铵根离子浓度增大.
解答:
解:A.氯化铵溶液中遵循物料守恒,根据物料守恒可得:c(Cl-)=c(NH4+)+c(NH3?H2O),故A正确;
B.由于铵根离子只有很少的部分水解,溶液显示酸性,则c(NH4+)>c(H+)>c(OH-),溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B错误;
C.氯化铵溶液显示碱性,则c(H+)>c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可知,c(Cl-)>c(NH4+),则c(NH4+)+c(OH-)<c(Cl-)+c(H+),故C错误;
D.通入少量HCl,溶液中氯离子、氢离子浓度增大,由于氢离子浓度增大,抑制了铵根离子的水解,则溶液中铵根离子浓度增大,所以溶液中c(NH4+)和c(Cl-)均增大,故D正确;
故选AD.
B.由于铵根离子只有很少的部分水解,溶液显示酸性,则c(NH4+)>c(H+)>c(OH-),溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B错误;
C.氯化铵溶液显示碱性,则c(H+)>c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可知,c(Cl-)>c(NH4+),则c(NH4+)+c(OH-)<c(Cl-)+c(H+),故C错误;
D.通入少量HCl,溶液中氯离子、氢离子浓度增大,由于氢离子浓度增大,抑制了铵根离子的水解,则溶液中铵根离子浓度增大,所以溶液中c(NH4+)和c(Cl-)均增大,故D正确;
故选AD.
点评:本题考查盐类的水解、离子浓度大小比较,题目难度中等,试题侧重于影响盐类水解的因素的考查,有利于培养学生的良好的科学素养和提高学习的积极性,解题时结合影响盐类水解的因素,以及溶液中物料守恒、电荷守恒、质子守恒等守恒关系解答该题.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
实验室制氯气时,多余氯气用氢氧化钠溶液吸收,关于该反应的下列说法正确的是( )
| A、Cl2仅作氧化剂 |
| B、NaClO是还原产物 |
| C、每生成1mol NaCl,有1mol Cl2被氧化 |
| D、每转移1mol电子,有0.5mol Cl2被还原 |
(CH3)2CHCH2OH是某有机物的加氢还原产物,该有机物可能是( )
| A、正丁醛的同分异构体 |
| B、正丁醛的同系物 |
| C、CH3CH2COCH3(2-丁酮) |
| D、CH2=C(CH3)CHO |
下列说法中正确的是( )
| A、凡能起银镜反应的物质一定是醛 |
| B、乙醛能发生银镜反应,表明了醛具有氧化性 |
| C、在加热和有催化剂(如铜)的条件下,某些醇可能被空气中的O2所氧化,生成对应的醛或酮 |
| D、福尔马林是35%~40%的甲醛水溶液,可用于浸制生物标本 |
下列各组,可以用树状分类法进行分类的是( )
| A、烧杯、烧碱、燃烧、烧瓶 |
| B、酒精、酒精灯、水、盐酸 |
| C、干冰、一氧化碳、石墨、金刚石 |
| D、H2、HCl、NaOH、NaHCO3 |
白酒密封储存在地窖里,时间越长越香,形成这种香味效果的主要物质是( )
| A、醇类物质 | B、酯类物质 |
| C、酸类物质 | D、盐类物质 |
以下用于研究有机物的方法错误的是( )
| A、蒸馏常用于分离提纯液态有机混合物 |
| B、燃烧法是研究确定有机物成分的有效方法 |
| C、核磁共振氢谱通常用于分析有机物的相对分子质量 |
| D、对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
下列物质与盐酸或氢氧化钠溶液反应都能产生气体的是( )
| A、Na2CO3 |
| B、Al(OH)3 |
| C、Al2O3 |
| D、Al |
下列说法中不正确的是( )
| A、相同物质的量的有机物(含C、H、O三种元素中的两种或三种),完全燃烧时,若生成CO2的量与消耗O2的量都相同,则必须符合:不同有机物中碳原子数相同;若分子组成相差n个O原子,则同时相差2n个H原子 |
| B、按系统命名法:CH3CH2C(CH3)2CH(C2H5)CH3的正确名称是3,3,4-三甲基己烷 |
C、1mol的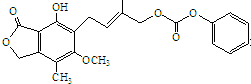 最多能与含6.0mol NaOH的水溶液完全反应 最多能与含6.0mol NaOH的水溶液完全反应 |
D、若完全燃烧,1mol雄酮( )比雌酮( )比雌酮(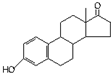 )多消耗3mol O2 )多消耗3mol O2 |