题目内容
25℃时,0.01 mol·L-1两种弱酸溶液的pH如表,下列说法正确的是
| A.相同pH的两种酸溶液中,CH3COOH溶液中水电离的c(H+)较大 |
| B.物质的量浓度相同的CH3COONa与NaCN 溶液中,CH3COONa溶液pH较大 |
| C.等体积pH相同的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH |
| D.HCN的电离平衡常数(Ka)与CN—的水解平衡常数(K)存在如下关系:Ka?K=Kw |
D
解析试题分析:A、pH相同,两种酸溶液的c(OH—)相同,则水电离的c(OH—),因此水电离的c(H+)也相同,错误;B、由已知条件可知,电离程度:CH3COOH>HCN,则水解程度:CH3COONa<NaCN,则CH3COONa溶液pH较小,错误;C、pH相同时,c(CH3COOH)<c(HCN),由c?V可知,n(CH3COOH)<n(HCN),故HCN消耗的NaOH较多,错误;D、Ka=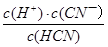 ,K=
,K= ,Kw=c(H+)?c(OH—),故Ka?K=Kw,正确。
,Kw=c(H+)?c(OH—),故Ka?K=Kw,正确。
考点:考查溶液的pH、水的离子积、盐类水解、电离常数、盐类水解平衡常数等相关知识。

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
下列电离或水解方程式中,正确的是
| A.CH3COOH=CH3COO-+H+ |
B.Br-+H2O  HBr+OH- HBr+OH- |
C.CO32-+2H2O  H2CO3+2OH- H2CO3+2OH- |
D.NH4++2H2O  NH3·H2O+H3O+ NH3·H2O+H3O+ |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验 编号 | c(HA)起始浓度/(mol·L-1) | c(KOH)起始浓度/(mol·L-1) | 反应后溶液的pH |
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.0.1 mol·L-1HA的溶液中由水电离出的 c(H+)=1×10-13 mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
下列叙述正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为: |
B.0.1 mol/L NaHA溶液的pH=4,该溶液中 |
| C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+l,则c1=10c2 |
| D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴人石蕊溶液呈红色 |
下列物质的水溶液因发生水解而显酸性的是
| A.NaHSO4 | B.KCl | C.NH4Cl | D.H2SO4 |
 2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能
2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能