题目内容
 某校研究性学习小组通过在相同条件下,金属与酸反应产生H2的快慢,比较Al和Fe的金属性强弱,设计了如下实验装置进行实验:
某校研究性学习小组通过在相同条件下,金属与酸反应产生H2的快慢,比较Al和Fe的金属性强弱,设计了如下实验装置进行实验:(1)如图中仪器A的名称是
锥形瓶
锥形瓶
,其中盛放的液体可能是稀盐酸(HCl)或稀硫酸(H2SO4)
稀盐酸(HCl)或稀硫酸(H2SO4)
.(2)实验前,必须对该装置的气密性进行检查,其检查的方法为
组装好仪器,把丙中导管插入盛水的烧杯中,用热毛巾捂住锥形瓶,若导管口有气泡冒出,冷却后,导管内形成一段高于烧杯内水面的水柱,则装置的气密性好
组装好仪器,把丙中导管插入盛水的烧杯中,用热毛巾捂住锥形瓶,若导管口有气泡冒出,冷却后,导管内形成一段高于烧杯内水面的水柱,则装置的气密性好
.
(3)比较两种金属产生氢气的快慢,一种方法是在相同时间内测量两种金属产生氢气的体积大小,另一方法可以是
测量产生相同体积的氢气,两种金属所需时间长短
测量产生相同体积的氢气,两种金属所需时间长短
.(4)用乙、丙装置来测定氢气的体积时,为确保测量的准确性,可采取的措施是
②③
②③
(填序号).①不必等到甲中的液体冷却至室温读出量筒内水的体积
②应使乙、丙中的水面相平时再读出量筒内水的体积
③读出量筒内水的体积时,不可俯视读数.
分析:(1)根据常见的化学仪器知识来回答,金属与酸反应产生H2的快慢,可以来比较Al和Fe的金属性强弱;
(2)根据检查装置气密性的办法来回答;
(3)两种金属和酸反应产生氢气的快慢可以根据时间和产生气体之间的关系来回答;
(4)乙、丙中的水面相平时测得的气体体积是常压下的体积;读数时,视线要和凹液面处相切.
(2)根据检查装置气密性的办法来回答;
(3)两种金属和酸反应产生氢气的快慢可以根据时间和产生气体之间的关系来回答;
(4)乙、丙中的水面相平时测得的气体体积是常压下的体积;读数时,视线要和凹液面处相切.
解答:解:(1)图中仪器A的名称是锥形瓶,根据题意:金属与酸反应产生H2的快慢,可以来比较Al和Fe的金属性强弱,所以锥形瓶中盛放的液体可能是稀盐酸(HCl)或稀硫酸(H2SO4),故答案为:锥形瓶;稀盐酸(HCl)或稀硫酸(H2SO4);
(2)检查装置气密性的办法:组装好仪器,把丙中导管插入盛水的烧杯中,用热毛巾捂住锥形瓶,若导管口有气泡冒出,冷却后,导管内形成一段高于烧杯内水面的水柱,则装置的气密性好,
故答案为:组装好仪器,把丙中导管插入盛水的烧杯中,用热毛巾捂住锥形瓶,若导管口有气泡冒出,冷却后,导管内形成一段高于烧杯内水面的水柱,则装置的气密性好;
(3)两种金属和酸反应产生氢气的快慢可以根据时间和产生气体之间的关系来判断,可以在相同时间内测量两种金属产生氢气的体积大小,还可以测量产生相同体积的氢气,两种金属所需时间长短,故答案为:测量产生相同体积的氢气,两种金属所需时间长短;
(4)用乙、丙装置来测定氢气的体积时,为确保测量的准确性,注意只有当乙、丙中的水面相平时测得的气体体积是常压下的体积,并且读数时,视线要和凹液面处相切,故选②③.
(2)检查装置气密性的办法:组装好仪器,把丙中导管插入盛水的烧杯中,用热毛巾捂住锥形瓶,若导管口有气泡冒出,冷却后,导管内形成一段高于烧杯内水面的水柱,则装置的气密性好,
故答案为:组装好仪器,把丙中导管插入盛水的烧杯中,用热毛巾捂住锥形瓶,若导管口有气泡冒出,冷却后,导管内形成一段高于烧杯内水面的水柱,则装置的气密性好;
(3)两种金属和酸反应产生氢气的快慢可以根据时间和产生气体之间的关系来判断,可以在相同时间内测量两种金属产生氢气的体积大小,还可以测量产生相同体积的氢气,两种金属所需时间长短,故答案为:测量产生相同体积的氢气,两种金属所需时间长短;
(4)用乙、丙装置来测定氢气的体积时,为确保测量的准确性,注意只有当乙、丙中的水面相平时测得的气体体积是常压下的体积,并且读数时,视线要和凹液面处相切,故选②③.
点评:本题是一道综合知识题目,考查学生分析和解决问题的能力,可以根据所学知识进行回答,难度较大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下表是甲城市某日空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究.
实验一:用如图所示装置进行实验.

①A装置的作用是 (填“干燥”或“氧化”)SO2气体.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸,该酸的化学式是 .
③D装置的作用是 .若实验中向装置内通入标准状况下2.24L SO2气体,且NaOH溶液过量.最多能生成Na2SO3的物质的量为 mol.(反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O)
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的显 性(“酸”“碱”“中”),然后每隔1h测定其pH,发现pH逐渐变小,直至恒定.说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4. SO2形成酸雨的另一途径; SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4.在此过程中飘尘作 .(填“氧化剂”或“催化剂”)
SO2与空气中的氧气、水反应生成硫酸而形成酸雨.本市可能易出现酸雨.
(1)酸雨造成的危害是: (举一例).
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因.
本市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加入 (填“水”或“乙醇”).
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 | SO2 | II | 良 |
实验一:用如图所示装置进行实验.

①A装置的作用是
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变
③D装置的作用是
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的显
(1)酸雨造成的危害是:
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为
本市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加入
下表是某城市某日的空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
(1)用如图所示装置进行实验.

①A装置的作用是 (填“干燥”或“氧化”)SO2气体.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸.
③D装置的作用是 .D中发生反应的化学方程式是 .
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐 (填“变大”或“变小”),直至恒定.说明烧杯中的溶液被空气中的氧气氧化最终生成H2SO4.
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为 (填“催化剂’’或“氧化剂”).
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因.
| 污染指数 | 首要污染物 | 空气质量等级 | 空气质量状况 |
| 55 | SO2 | Ⅱ | 良 |
(1)用如图所示装置进行实验.

①A装置的作用是
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变
③D装置的作用是
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为
海带中含有碘元素,某校研究性学习小组设计了如下实验步骤来提取碘:
①通足量氯气;②将海带烧成灰,向灰中加水搅拌;③加CC14振荡;④过滤;⑤用分液漏斗分液.
合理的操作顺序为( )
①通足量氯气;②将海带烧成灰,向灰中加水搅拌;③加CC14振荡;④过滤;⑤用分液漏斗分液.
合理的操作顺序为( )
| A、①→③→⑤→②→④ | B、②→①→③→④→⑤ | C、②→④→①→③→⑤ | D、③→①→②→⑤→④ |

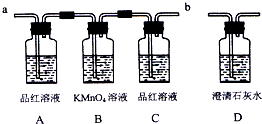 某校研究性学习小组,设计如下装置来验证浓硫酸与木炭在加热条件下的产物中含有SO2和CO2.同学们查阅资料得知二氧化硫可使酸性高锰酸钾溶液褪色,化学方程式为:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
某校研究性学习小组,设计如下装置来验证浓硫酸与木炭在加热条件下的产物中含有SO2和CO2.同学们查阅资料得知二氧化硫可使酸性高锰酸钾溶液褪色,化学方程式为:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4