题目内容
(2012?百色二模)下列对于溶液中的说法正确的是( )
分析:A、依据Na2CO3水解方程式分析判断;
B、加水稀释溶液浓度减小,氢离子浓度减小,氢氧根离子浓度增大;
C、若溶液中c2(OH-)=KW,则c(OH-)=c(H+)溶液显中性,温度不知道,pH不确定;D、铵根离子抑制了氨水的电离.
B、加水稀释溶液浓度减小,氢离子浓度减小,氢氧根离子浓度增大;
C、若溶液中c2(OH-)=KW,则c(OH-)=c(H+)溶液显中性,温度不知道,pH不确定;D、铵根离子抑制了氨水的电离.
解答:解:A、Na2CO3分两步水解,其水解方程式为CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,所以溶液中c(OH-)大于c(HCO-3),故A错误;
B、加水稀释溶液浓度减小,电离平衡正移,氢离子物质的量增大,溶液体积也增大,而且体积增大的程度比氢离子物质的量增大的程度大,所以氢离子浓度减小,溶液中KW=c(OH-)?c(H+)是常数,所以氢氧根离子浓度增大,故B错误;
C、若溶液中c2(OH-)=KW,则c(OH-)=c(H+)溶液显中性,温度不知道,pH不确定,所以溶液的pH可能小于7,故C正确;
D、氨水中存在NH3?H2O?NH4++OH-,加入氯化铵,铵根离子抑制了氨水的电离,故D错误;
故选C.
B、加水稀释溶液浓度减小,电离平衡正移,氢离子物质的量增大,溶液体积也增大,而且体积增大的程度比氢离子物质的量增大的程度大,所以氢离子浓度减小,溶液中KW=c(OH-)?c(H+)是常数,所以氢氧根离子浓度增大,故B错误;
C、若溶液中c2(OH-)=KW,则c(OH-)=c(H+)溶液显中性,温度不知道,pH不确定,所以溶液的pH可能小于7,故C正确;
D、氨水中存在NH3?H2O?NH4++OH-,加入氯化铵,铵根离子抑制了氨水的电离,故D错误;
故选C.
点评:本题考查了盐类水解平衡,弱电解质的电离平衡,本题难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
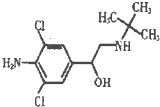 (2012?百色二模)瘦肉精学名盐酸克伦特罗,其结构简式如图.下列关于瘦肉精的说法不正确的是
(2012?百色二模)瘦肉精学名盐酸克伦特罗,其结构简式如图.下列关于瘦肉精的说法不正确的是