题目内容
11.用CH4催化还原NOx可以消除氮氧化物的污染.已知 CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1.
若在标准状况下5.6L CH4恰好能将一定量NO2还原成N2和H2O(g),则整个过程中放出的热量为( )
| A. | 114.8 kJ | B. | 216.8 kJ | C. | 232 kJ | D. | 173.4 kJ |
分析 利用盖斯定律分析,不管化学反应是一步或分几步完成,其反应热是不变的;依据热化学方程式和盖斯定律构造目标热化学方程式计算反应热.
解答 解:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-l,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2 O(g)△H=-1160kJ•mol-l,由盖斯定律计算[①+②]×$\frac{1}{2}$得到CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-867 kJ•mol-1;在标准状况下5.6LCH4还原NO2至N2,放出的热量=$\frac{5.6L}{22.4L/mol}$×867kJ/mol=216.8kJ,
故选B.
点评 本题考查了盖斯定律的应用,要注意方程式计量数的变化,及△H的符号的变化,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
1.下列关于有机化合物的说法正确的是( )
| A. | 糖类、油脂和蛋白质均可发生水解反应 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | 乙烯、聚氯乙烯和苯分子均含有碳碳双键 | |
| D. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 |
19.元素周期表和元素周期律可以指导人们进行推测和判断.下列说法不合理的是( )
| A. | 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | |
| B. | ⅥA族元素的原子,其半径越大,气态氢化物越稳定 | |
| C. | 硅、锗都位于金属与非金属的交界处,都可以作半导体材料 | |
| D. | Cs和Ba分别位于第六周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2 |
6.下列说法错误的是( )
| A. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| B. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| C. | 冷的氢氧化钠溶液中通入氯气发生反应:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 氯气在饱和食盐水中的溶解度小于在纯水中的溶解度 |
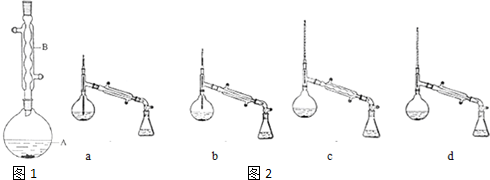
16.乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图如图1和有关数据如下:
实验步骤:
在A中加入6.6g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温.
分离提纯:
将反应液倒入分液漏斗中,分别用饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水氯化钙颗粒,静置一段时间后除去氯化钙,最终通过蒸馏,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)装置B的名称是:球形冷凝管
(2)加入碎瓷片的作用是防止暴沸,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)在洗涤操作中,用饱和碳酸氢钠溶液洗涤的主要目的是:洗掉醋酸和硫酸;
(4)分液漏斗在使用前须清洗干净并检漏,分液操作中,应充分振荡,然后静置,待分层后C(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C. 先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
(5)分离提纯过程中加入无水氯化钙的目的是_干燥(或除水).
(6)在蒸馏操作中,仪器选择及安装都正确的是如图2:d(填标号)
(7)本实验的产率是:40%.
| 相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |

实验步骤:
在A中加入6.6g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温.
分离提纯:
将反应液倒入分液漏斗中,分别用饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水氯化钙颗粒,静置一段时间后除去氯化钙,最终通过蒸馏,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)装置B的名称是:球形冷凝管
(2)加入碎瓷片的作用是防止暴沸,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)在洗涤操作中,用饱和碳酸氢钠溶液洗涤的主要目的是:洗掉醋酸和硫酸;
(4)分液漏斗在使用前须清洗干净并检漏,分液操作中,应充分振荡,然后静置,待分层后C(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C. 先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
(5)分离提纯过程中加入无水氯化钙的目的是_干燥(或除水).
(6)在蒸馏操作中,仪器选择及安装都正确的是如图2:d(填标号)
(7)本实验的产率是:40%.
20.下列关于化学键的说法中正确的是( )
| A. | 单质分子中不一定存在共价键 | |
| B. | 离子化合物一定不含共价键 | |
| C. | 只由非金属元素组成的物质一定不含离子键 | |
| D. | 物质组成中含有金属元素的一定含有离子键 |
 请完成下列各题:
请完成下列各题: