题目内容
【题目】氮氧化物能形成酸雨和光化学烟雾,严重污染环境。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·moll
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·moll
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________。
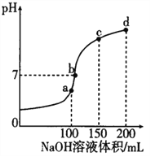
(2)在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,在一定条件下发生反应,反应过程中NO的物质的量随时间变化如图所示。

①写出该反应的化学方程式______________________________________。
②10 min内该反应的速率v(CO)=__________________;T℃时,该化学反应的平衡常数K=_______。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________。(填序号)

④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,下列选项能判断反应已达到化学平衡状态的是____________。
A.容器中压强不再变化 B.混合气体的平均相对分子质量不再变化
C.2v正(NO)=v逆(N2) D.气体的密度不再变化
【答案】CH4(g)+2NO2(g)![]() N2(g)+ CO2(g)+2H2O(g) △H=867 kJ·moll 2NO+2CO
N2(g)+ CO2(g)+2H2O(g) △H=867 kJ·moll 2NO+2CO![]() N2+2CO2 0.010 mol·Ll·minl K=5 bc AB
N2+2CO2 0.010 mol·Ll·minl K=5 bc AB
【解析】
(1)根据盖斯定律进行计算;
(2)①NO和CO在一定条件下转化为 N2和CO2,据此写出反应的化学方程式;
②根据v(NO)=n(NO)/Vt进行计算;求出该温度下各物质的平衡浓度,然后根据K= c2(CO2)c(N2)/c2(CO)c2(NO)带入数值进行计算;
③结合2NO+2CO![]() N2+2CO2△H<0反应特点,根据外界条件的改变对平衡移动影响的规律进行分析;
N2+2CO2△H<0反应特点,根据外界条件的改变对平衡移动影响的规律进行分析;
④根据平衡状态的判断依据:正逆反应速率相等,各组分的浓度保持不变及由此衍生出的其他物理量变化情况进行分析判断。
(1)①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·mol-1;②CH4(g)+4NO(g)
4NO(g)+CO2(g)+2H2O(g) △H= 574 kJ·mol-1;②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·mol-1;根据盖斯定律可知:1/2×[①+②]可得:CH4(g)+2NO2(g)
2N2(g)+CO2(g)+2H2O(g) △H= 1160 kJ·mol-1;根据盖斯定律可知:1/2×[①+②]可得:CH4(g)+2NO2(g)![]() N2(g)+ CO2(g)+2H2O(g)△H=1/2×(574-1160)=867 kJ·mol-1;
N2(g)+ CO2(g)+2H2O(g)△H=1/2×(574-1160)=867 kJ·mol-1;
综上所述,本题答案是:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)△H=867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g)△H=867 kJ·mol-1。
(2)①将NO和CO转化成无污染气体参与大气循环,则气体为N2和CO2,根据图像分析,NO并未完全反应,该反应为可逆反应,化学方程式为:2NO+2CO![]() N2+2CO2;
N2+2CO2;
综上所述。本题答案是:2NO+2CO![]() N2+2CO2 。
N2+2CO2 。
②10min时,NO的物质的量变化为△n(NO)=0.4mol-0.2mol=0.2mol,容器体积为V=2L,根据化学反应平均速率的公式v(NO)=n(NO)/Vt=0.2/10×2=0.01mol/(L·min),T℃时,反应达到平衡时,容器中各组分的浓度为c(NO)=0.2/2=0.1mol/L,c(CO)=0.2/2=0.1mol/L,c(N2)=0.1/2=0.05mol/L,c(CO2)=0.2/2=0.1mol/L,则该化学反应的平衡常数K=c2(CO2) c(N2)/c2(CO)c2(NO)=0.12×0.05/0.12×0.12=5L/mol;
综上所述,本题答案是:0.010 mol·Ll·minl ,K=5。
③2NO+2CO![]() N2+2CO2△H<0。
N2+2CO2△H<0。
a.随着温度升高,反应为放热反应,则化学平衡向逆反应方向移动,平衡常数随温度的升高而减小,故a错误;
b.增加N2物质的量,化学平衡向逆反应方向移动,NO的转化率降低,故b正确;
c.平衡常数只随温度的改变而改变,改变NO的量不改变化学平衡常数,故c正确;
d.随着温度升高,反应为放热反应,则化学平衡向逆反应方向移动,CO的转化率降低,故d错误;
综上所述,本题选bc;
④A.反应为气体分子数发生变化的反应,即随着反应进行,压强发生变化,当容器中压强不再变化时,可以判断化学反应达到平衡状态,故A可选;
B.CO2为生成物,当CO2的浓度不再改变时,可判断化学反应达到平衡状态,故B可选;
C.
D.气体密度ρ=m/V,反应前后气体质量m不变,体积为恒容容器,V不变,则化学反应达到平衡前后,气体密度始终不变,不可以判断化学反应是否达到平衡,故D不选;
综上所述,本题选AB。