题目内容
铁镍蓄电池又称爱迪生电池,电池的电解液为碱性溶液,放电时的总反应为:
Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2.
①工作时电池负极是 (填电极材料).
②负极电极反应式: .
③当外电路中通过0.2mol电子时,理论上消耗的铁的质量 克.
Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2.
①工作时电池负极是
②负极电极反应式:
③当外电路中通过0.2mol电子时,理论上消耗的铁的质量
考点:化学电源新型电池
专题:电化学专题
分析:根据电池的总反应:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,放电时Fe作负极,发生氧化反应失电子生成Fe2+,最终生成Fe(OH)2;Ni2O3作正极,发生还原反应,得电子,最终生成Ni(OH)2;
电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2,正极反应为Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-.
电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2,正极反应为Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-.
解答:
解:①根据电池反应式知,Fe元素化合价由0价变为+2价,所以Fe作负极,故答案为:Fe;
②电池放电时,负极上铁失电子和氢氧根离子反应生成氢氧化亚铁,反应为Fe+2OH--2e-=Fe(OH)2,故答案为:Fe+2OH--2e-═Fe(OH)2;
③根据Fe+2OH--2e-═Fe(OH)2知,通过0.2mol电子时消耗铁的质量=
×56g/mol=5.6g,故答案为:5.6.
②电池放电时,负极上铁失电子和氢氧根离子反应生成氢氧化亚铁,反应为Fe+2OH--2e-=Fe(OH)2,故答案为:Fe+2OH--2e-═Fe(OH)2;
③根据Fe+2OH--2e-═Fe(OH)2知,通过0.2mol电子时消耗铁的质量=
| 0.2mol |
| 2 |
点评:本题考查了化学电源新型电池,根据电池反应式中元素化合价变化确定正负极,难点是电极反应式的书写,再结合各个物理量之间的关系式计算,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列叙述中,错误的是( )
| A、硅广泛存在自然界中,天然单质硅叫硅石 |
| B、晶体硅结构类似于金刚石,硬度也很大 |
| C、氢氟酸能和玻璃发生化学反应,所以氢氟酸要存放在塑料瓶中 |
| D、烧碱液能腐蚀玻璃并生成硅酸钠,所以烧碱液要存放在带橡胶塞的玻璃瓶中 |
下列情况下,离子组间一定能在溶液中同时大量共存的是( )
| A、pH=2的溶液中:SO42-、K+、NO3-、Mg2+ |
| B、pH试纸呈现红色的溶液:Fe2+、K+、NO3-、Na+ |
| C、水电离出的c(H+)=10-14mol/L的溶液中:Na+、HCO3-、Cl-、SO42- |
| D、CO32-可以大量存在的溶液:Ag+、K+、NO3-、Al3+ |
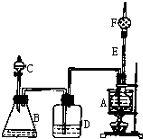 已知,CH3CH2OH+NaBr+H2SO4
已知,CH3CH2OH+NaBr+H2SO4