题目内容
【题目】人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断氧化银是( )
A. 负极,被氧化B. 正极,被还原C. 负极,被还原D. 正极,被氧化
【答案】B
【解析】
原电池中正极上发生得电子的还原反应,负极上发生失电子的氧化反应。
根据Ag2O+H2O+2e-=2Ag+2OH-,氧化银中银元素化合价降低,发生还原反应,所以氧化银是正极,被还原,故选B。

【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(1)ClO2的制备:
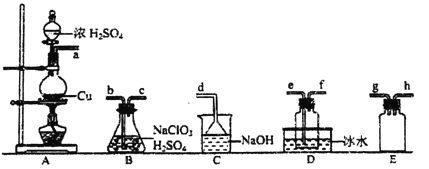
已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4
①装置A中反应的化学方程式为__________。
②欲收集ClO2,选择上图中的装置,其连接顺序为a→__________(按气流方向,用小写字母表示)。
③装置D的作用是___________________。
(2)C1O2与Na2S的反应

将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究I中反应的产物。
操作步骤 | 实验现象 | 结论 |
取少量I中溶液于试管甲中,滴加品红溶液和盐酸。 | 品红始终不褪色 | ①无_________生成 |
另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②____________ | 有SO42-生成 |
③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,_______。 | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S的反应的离子方程式为______________,用于处理含硫废水时,ClO2相对于Cl2的优点是_________________(任写一条)。

