جâؤ؟ؤعبف
،¾جâؤ؟،؟[»¯ر§ر،ذق3£؛خïضت½ل¹¹سëذشضت،؟
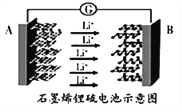
ôن´نتاسٌت¯ضذµؤز»ضض£¬ئنض÷زھ³ة·ضخھ¹èثلآءؤئ-NaAI(Si2O6)£¬³£؛¬خ¢ء؟Cr،¢Ni،¢Mn،¢Mg،¢Feµبشھثط،£»ط´ًدآءذختجâ£؛
(l)»ùج¬Crش×سµؤµç×سإإ²¼ت½خھ____£»Feخ»سعشھثطضـئع±يµؤ___ اّ،£
(2)ôن´نضذض÷زھ³ة·ض¹èثلأھؤئ±يت¾خھرُ»¯خïµؤ»¯ر§ت½خھ____£¬ئنضذثؤضضشھثطµعز»µçہëؤـسةذ،µ½´َµؤث³ذٍتا____،£
(3)¸ئ؛حجْ²؟تاµعثؤضـئعشھثط£¬ازش×سµؤ×îحâ²مµç×ستدàح¬£¬خھت²أ´جْµؤبغ·ذµمش¶´َسع¸ئ£؟____،£
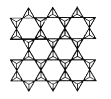
(4)شع¹èثلرخضذ´وشع![]() ½ل¹¹µ¥شھ£¬ئنضذSiش×سµؤشس»¯¹ىµہہàذحخھ____،£µ±خقدق¶à¸ِ£¨سأn±يت¾£©
½ل¹¹µ¥شھ£¬ئنضذSiش×سµؤشس»¯¹ىµہہàذحخھ____،£µ±خقدق¶à¸ِ£¨سأn±يت¾£©![]() ·ض±ًزش3¸ِ¶¥½ارُ؛حئنثû3¸ِ
·ض±ًزش3¸ِ¶¥½ارُ؛حئنثû3¸ِ![]() ذخ³ة²م×´½ل¹¹ت±£¨بçح¼ثùت¾£©£¬ئنضذSi،¢Oش×سµؤتؤ؟ض®±بخھ____،£
ذخ³ة²م×´½ل¹¹ت±£¨بçح¼ثùت¾£©£¬ئنضذSi،¢Oش×سµؤتؤ؟ض®±بخھ____،£
بôئنضذسذز»°ëµؤSi±»Alجو»»£¬ئن»¯ر§ت½خھ____،£
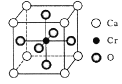
(5) Cr؛حCa؟ةزشذخ³ةضض¾كسذجطتâµ¼µçذشµؤ¸´؛درُ»¯خ¾§°û½ل¹¹بçح¼ثùت¾،£¸أ¾§جهµؤ»¯ر§ت½خھ____£¬بôCaسëOµؤ؛ث¼ن¾àہëخھx nm£¬شٍ¸أ¾§جهµؤأـ¶بخھ___ g/cm3،£
،¾´ً°¸،؟ [Ar] 3d54s1 dاّ Na2O،¤Al2O3،¤4SiO2 Na£¼Al£¼Si£¼O Feµؤ؛ثµç؛ةت½د´َ£¬؛ث¶شµç×سµؤزء¦½د´َ£¬¹تFeµؤش×س°ë¾¶ذ،سعCa£¬Feµؤ½ًتô¼üا؟سعCa sp3 2©U5 [AlSiO5]![]() CaCrO3
CaCrO3 ![]()
،¾½âخِ،؟(l) Crخھ24؛إشھثط£¬¸ù¾ف؛ثحâµç×سإإ²¼¹وآة»ùج¬Crش×سµؤµç×سإإ²¼ت½خھ[Ar] 3d54s1£¬Feخھ26؛إشھثط£¬خ»سعµعبضـئعµعVIII×ه£¬ز²¾حتاشھثطضـئع±يµؤdاّ،£´ً°¸خھ£؛[Ar] 3d54s1 ،¢dاّ
£¨2£©¹èثلآءؤئضذNaخھ+1¼غ£¬ Alخھ+3¼غ£¬ Siخھ+4¼غ£¬Oخھ-2¼غ£¬ثùزش±يت¾خھرُ»¯خïµؤ»¯ر§ت½خھNa2O،¤Al2O3،¤4SiO2£»·ا½ًتôذشش½ا؟µعز»µçہëؤـش½´َ£¬ح¬ز»ضـئعµؤشھثط×ش×َدٍسزµعز»µçہëؤـشِ´َ£¬زٍ´ثNa،¢ Al،¢ Si،¢O ثؤضضشھثطµعز»µçہëؤـسةذ،µ½´َµؤث³ذٍتاNa£¼Al£¼Si£¼O ،£´ً°¸خھ£؛Na2O،¤Al2O3،¤4SiO2 ،¢Na£¼Al£¼Si£¼O
£¨3£©¸ئ؛حجْ´¦سعح¬ز»ضـئع£¬µ«جْµؤ؛ثµç؛ةت´َسع¸ئ£¬¶ش×îحâ²مµç×سµؤخüزؤـء¦ا؟£¬ت¹×îحâ²مµç×سش½؟؟½üش×س؛ث£¬µ¼ضآجْµؤش×س°ë¾¶ذ،سع¸ئ£¬زٍ´ث½ًتô¼üا؟سع¸ئ£¬ثùزشجْµؤبغ·ذµمش¶´َسع¸ئ،£´ً°¸خھ£؛Feµؤ؛ثµç؛ةت½د´َ£¬؛ث¶شµç×سµؤزء¦½د´َ£¬¹تFeµؤش×س°ë¾¶ذ،سعCa£¬Feµؤ½ًتô¼üا؟سعCa
(4) شع¹èثلرخضذ£¬¹èثل¸ù£¨SiO44-£©خھصثؤأوجه½ل¹¹£¬أ؟¸ِSiسëضـخ§4¸ِOذخ³ة4¸ِ¦ز¼ü£¬Siخق¹آµç×س¶ش£¬ثùزشضذذؤش×سSiش×س²ةب،ءثsp3شس»¯·½ت½£»أ؟¸ِثؤأوجهح¨¹ب¸ِرُش×سسëئنثûثؤأوجهء¬½سذخ³ة²م×´½ل¹¹£¬زٍ¶ّأ؟¸ِثؤأوجهضذ¹èش×ستتا1£¬رُش×ست£½1£«3،ء![]() £½
£½![]() £¬¼´SiسëOµؤش×س¸ِت±بخھ2£؛5£¬»¯ر§ت½خھ(Si2nO5n)2n-£¬بôئنضذز»°ëµؤSi±»Alجو»»£¬ئن»¯ر§ت½خھ
£¬¼´SiسëOµؤش×س¸ِت±بخھ2£؛5£¬»¯ر§ت½خھ(Si2nO5n)2n-£¬بôئنضذز»°ëµؤSi±»Alجو»»£¬ئن»¯ر§ت½خھ![]() ´ً°¸خھ£؛2£؛5،¢
´ً°¸خھ£؛2£؛5،¢![]()
(5) ¸ù¾ف¾§°û½ل¹¹ح¼؛ح¾ùج¯·¨؟ةضھ£¬¾§°ûضذOش×ستخھ،ء6=3£¬Caش×ستخھ،ء8=1£¬Crش×ستخھ1£¬شٍ»¯ر§ت½خھCaCrO3£»ة辧°ûµؤ±ك³¤خھacm£¬سةسعCaسëOµؤ؛ث¼ن¾àہëخھxnm£¬شٍ2a2=4x2![]() £¬ثùزشa=
£¬ثùزشa=![]() cm, CaCrO3µؤت½ء؟خھ£؛140£¬زٍ´ثز»¸ِ¾§°ûµؤضتء؟m=
cm, CaCrO3µؤت½ء؟خھ£؛140£¬زٍ´ثز»¸ِ¾§°ûµؤضتء؟m=![]() g£¬¶ّ¾§°ûµؤجه»V=
g£¬¶ّ¾§°ûµؤجه»V=![]() cm3£¬ثùزش¸أ¾§جهµؤأـ¶ب¦ر=
cm3£¬ثùزش¸أ¾§جهµؤأـ¶ب¦ر=![]() =
=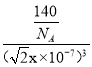 =
=![]() g/cm3£¬´ً°¸خھ£؛ CaCrO3،¢
g/cm3£¬´ً°¸خھ£؛ CaCrO3،¢![]()

،¾جâؤ؟،؟µخ¶¨تµرéتا»¯ر§ر§؟ئضذضطزھµؤ¶¨ء؟تµر飮 زرضھؤ³NaOHتشرùضذ؛¬سذNaClشسضت£¬خھ²â¶¨تشرùضذNaOHµؤضتء؟·ضت£¬½ّذذبçدآتµرé£؛
¢ظ³ئء؟1.0gرùئ·بـسعث®£¬إن³ة250mLبـز؛£»
¢ع×¼ب·ء؟ب،25.00mLثùإنبـز؛سع׶ذخئ؟ضذ£»
¢غµخ¼س¼¸µخ·سجھبـز؛£»
¢ـسأ0.1000mol/Lµؤ±ê×¼رخثلµخ¶¨ب´خ£¬أ؟´خدû؛ؤرخثلµؤجه»¼اآ¼بç±ي£؛
µخ¶¨ذٍ؛إ | ´²âز؛جه»£¨mL£© | ثùدû؛ؤ±ê×¼رخثلµؤجه»£¨mL£© | |
µخ¶¨ا° | µخ¶¨؛َ | ||
¢ظ | 25.00 | 0.50 | 20.60 |
¢ع | 25.00 | 6.00 | 26.00 |
¢غ | 25.00 | 1.10 | 21.00 |
اë»ط´ًدآءذختجâ£؛
£¨1£©µخ¶¨ضصµمت±µؤدضدَتا £®
£¨2£©ثùإنضئµؤ250mLرùئ·ز؛ضذNaOHµؤخïضتµؤء؟إ¨¶بتا molL©پ1£»تشرùضذNaOHµؤضتء؟·ضتخھ £®
£¨3£©بô³ِدضدآءذاé؟ِ£¬²â¶¨½ل¹ûئ«¸كµؤتا £® a£®µخ¶¨ا°سأصôءَث®³هد´×¶ذخئ؟
b£®شعز،¶¯×¶ذخئ؟ت±²»ة÷½«ئ؟ؤعبـز؛½¦³ِ
c£®µخ¶¨ا°سذئّإف£¬µخ¶¨؛َئّإفدûت§
d£®ثلت½µخ¶¨¹ـµخضءضصµم¶ش£¬¸©تس¶ءت
e£®ثلت½µخ¶¨¹ـسأصôءَث®د´؛َ£¬خ´سأ±ê×¼ز؛بَد´£®