题目内容
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
试回答下列问题:
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E);
(2)在1L密闭容器中通入10 molCO和10 mol水蒸气,在500℃下经过30s达到平衡,则30s内CO的平均反应速率为 。
(3)已知在一定温度下,C(s)+CO2(g) 2CO(g)平衡常数K;K的表达式 ;
2CO(g)平衡常数K;K的表达式 ;
C(s)+H2O(g) CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;
则K、K1、K2之间的关系是: ;
(4)某温度下C(s)+CO2(g) 2CO(g)能判断该反应达到化学平衡状态的依据是________。
2CO(g)能判断该反应达到化学平衡状态的依据是________。
A.c(CO2)=c(CO) B.K不变 C.容器中的压强不变
D.v正(CO)=2v正(CO2) E.c(CO)保持不变 F.混合气体相对分子质量不变
(5)如图1所示,在甲、乙两容器中都充入1molC和1molCO2,并使甲、乙两容器初始容积相等。在相同温度下发生反应C(s)+CO2(g) 2CO(g),并维持反应过程中温度不变。已知甲容器中
2CO(g),并维持反应过程中温度不变。已知甲容器中
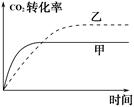
CO2的转化率随时间变化的图像如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图像。
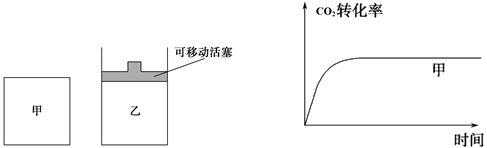
图1 图2
已知:CO(g)+H2O(g)
 H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E);
| | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
(3)已知在一定温度下,C(s)+CO2(g)
 2CO(g)平衡常数K;K的表达式 ;
2CO(g)平衡常数K;K的表达式 ;C(s)+H2O(g)
 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;CO(g)+H2O(g)
 H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是: ;
(4)某温度下C(s)+CO2(g)
 2CO(g)能判断该反应达到化学平衡状态的依据是________。
2CO(g)能判断该反应达到化学平衡状态的依据是________。A.c(CO2)=c(CO) B.K不变 C.容器中的压强不变
D.v正(CO)=2v正(CO2) E.c(CO)保持不变 F.混合气体相对分子质量不变
(5)如图1所示,在甲、乙两容器中都充入1molC和1molCO2,并使甲、乙两容器初始容积相等。在相同温度下发生反应C(s)+CO2(g)
 2CO(g),并维持反应过程中温度不变。已知甲容器中
2CO(g),并维持反应过程中温度不变。已知甲容器中CO2的转化率随时间变化的图像如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图像。

图1 图2
(1)BCE (2) 0.25mol·L-1·s-1
(3)K=
 K=K1/K2 (4)CEF
K=K1/K2 (4)CEF (5)
试题分析:(1)先求各个情况下的生成物浓度幂之积与反应浓度幂之积的比:Q(A)=1.2;Q(B)=0.25;Q(D)=1;Q(E)=0.67;可以看出只有BCE向正反应方向移动,而A是逆向移动,D已达到平衡状态。
CO(g)+H2O(g)
 H2(g)+CO2(g)
H2(g)+CO2(g)起始: 10mol 10mol 0 0
变化: x x x x
平衡:(10-x) (10-x) x x
依题意有:

解之得:X=7.5mol
则30s内CO的平均反应速率为:
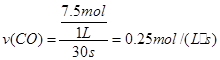
因为碳是固体,因此浓度是定值,在平衡常数表达式中不写出碳。
① C(s)+CO2(g)
 2CO(g) 平衡常数K;
2CO(g) 平衡常数K;② C(s)+H2O(g)
 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;③ CO(g)+H2O(g)
 H2(g)+CO2(g) 平衡常数K2;
H2(g)+CO2(g) 平衡常数K2;①就等于②-③,因此平衡常数K=K1/K2
(5)乙相当于甲在相同条件下达到平衡后再减小压强,平衡继续右移,二氧化碳的转化率增大,但是达到平衡的时间会加长,因为压强减小,减慢了反应的速率。

练习册系列答案
相关题目
 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。
 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是(双选) ( )。
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是(双选) ( )。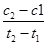
 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图: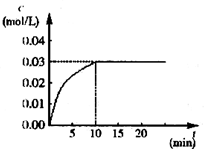
 Y(g) + Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是
Y(g) + Z(g) △H<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是 2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为