题目内容
写出符合下列情况的化学方程式或离子方程式。(1)一种单质氧化另一种单质:___________________________________。
(2)一种单质氧化一种阳离子:___________________________________。
(3)一种单质氧化一种阴离子:___________________________________。
(4)一种单质还原一种阳离子:___________________________________。
(5)一种阳离子氧化一种阴离子:___________________________________。
(6)同一化合物中的一种元素氧化另一种元素:_______________________________。
(7)同一化合物中同一种元素之间发生氧化还原反应:_________________________。
(1)Cl2+H2![]() 2HCl
2HCl
(2)Cl2+2Fe2+===2Fe3++2Cl-
(3)Cl2+2I-===I2+2Cl-
(4)Zn+2H+===Zn2++H2↑
(5)2Fe3++S2-===2Fe2++S↓
(6)2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(7)3NO2+H2O===2HNO3+NO(其他答案也可)

[化学选修-物质结构与性质](13分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的氢化物的分子空间构型是 ,其中心原子采取 杂化,属于 (填“极性分子”和“非极性分子”)。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
| 元 素 | M | F | |
| 电离能 (kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是 ;
(4)晶体熔点:DC EC(填“<、=、>”),原因是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
|
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因 ?
(6)已知某化合反应,在反应过程中只有σ键的断裂与生成,写出符合要求的化学方程式
(写一个)。
 (其中R为饱和烃基),A在一定条件下有如图所示的转化关系.已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2.
(其中R为饱和烃基),A在一定条件下有如图所示的转化关系.已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2.





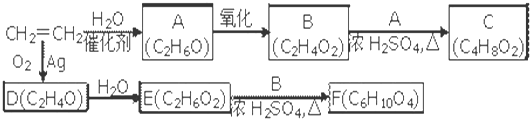

 (其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
(其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。