题目内容
下列关于弱电解质的说法中正确的是( )
| A、弱电解质需要通电才能发生电离 |
| B、醋酸溶液达到电离平衡时,不存在CH3COO-+H+?CH3COOH |
| C、H2SO4是共价化合物,所以它是弱电解质;NaOH是离子化合物,所以是强电解质 |
| D、弱电解质溶液中,既有溶质分子,又有溶质电离出的离子 |
考点:强电解质和弱电解质的概念,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.电解质溶于水或熔化下电离与通电无关;
B.醋酸为弱酸,溶液中存在电离平衡;
C.有些强电解质为共价化合物,有些弱电解质为离子化合物,H2SO4是共价化合物,是强电解质;NaOH是离子化合物,是强电解质;
D.弱电解质部分电离,则在溶液中存在分子和离子之间的电离平衡;
B.醋酸为弱酸,溶液中存在电离平衡;
C.有些强电解质为共价化合物,有些弱电解质为离子化合物,H2SO4是共价化合物,是强电解质;NaOH是离子化合物,是强电解质;
D.弱电解质部分电离,则在溶液中存在分子和离子之间的电离平衡;
解答:
解:A.电解质溶于水或熔化下电离,通电时离子作定向移动,电离与通电无关,只要是电解质就能电离,与强弱无关,故A错误;
B.稀溶液中存在电离平衡,应存在弱电解质,醋酸为弱酸,溶液中存在电离平衡,CH3COO-+H+?CH3COOH,故B错误;
C.强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物.即溶于水的部分或者熔融状态时,可以完全变成阴阳离子的化合物.有些强电解质为共价化合物,有些弱电解质为离子化合物,如氯化氢为强电解质,但氯化氢为共价化合物,氢氧化铝为弱电解质,但它是离子化合物,H2SO4是共价化合物,是强电解质;NaOH是离子化合物,是强电解质,故C错误;
D.弱电解质部分电离,则在溶液中存在分子和离子之间的电离平衡,所以既有溶质分子,又有溶质电离出的离子,故D正确;
故选D.
B.稀溶液中存在电离平衡,应存在弱电解质,醋酸为弱酸,溶液中存在电离平衡,CH3COO-+H+?CH3COOH,故B错误;
C.强电解质是指:在水溶液中或熔融状态下,能够完全电离的化合物.即溶于水的部分或者熔融状态时,可以完全变成阴阳离子的化合物.有些强电解质为共价化合物,有些弱电解质为离子化合物,如氯化氢为强电解质,但氯化氢为共价化合物,氢氧化铝为弱电解质,但它是离子化合物,H2SO4是共价化合物,是强电解质;NaOH是离子化合物,是强电解质,故C错误;
D.弱电解质部分电离,则在溶液中存在分子和离子之间的电离平衡,所以既有溶质分子,又有溶质电离出的离子,故D正确;
故选D.
点评:本题考查了电解质的有关知识,注意“导电能力大小与离子浓度有关,与电解质强弱无关、电离与通电无关、化合物类型与电解质强弱无关”,是解答本题的关键,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列关于有机物的叙述中正确的是( )
| A、含碳量最高的烃类物质一定是苯 |
| B、相对分子质量相同的不同物质一定是同分异构体 |
| C、液化石油气和天然气的主要成分都是甲烷 |
| D、苯和乙烯都能与H2发生加成反应 |
下列关于物质或离子的检验操作、结论正确的是( )
| A、用铂丝蘸取某溶液在火焰上灼烧产生黄色火焰,则该溶液中一定含有钠离子,可能含有钾离子 |
| B、向溶液中加入盐酸,有白色沉淀,则溶液中一定含有Ag+ |
| C、能使品红溶液褪色的气体一定是SO2 |
| D、检验氯化亚铁是否变质,加入氢氧化钠,看是否有红褐色沉淀产生 |
苯有多种同系物,其中一种结构简式为: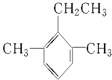 ,则它的名称为( )
,则它的名称为( )
 ,则它的名称为( )
,则它的名称为( )| A、2,4-二甲基-3-乙基苯 |
| B、1,3-二甲基-2-乙基苯 |
| C、1,5-二甲基-6-乙基苯 |
| D、2-乙基-1,3-二甲基苯 |
下列关于乙烯的叙述,正确的是( )
| A、乙烯分子里的两个碳原子和四个氢原子不处在同一平面 |
| B、乙烯分子中碳碳双键比乙烷分子中碳碳单键稳定 |
| C、乙烯分子中键的夹角是180° |
| D、可作水果的催熟剂 |
氯气是一种重要的工业原料.工业上利用反应:3Cl2+8NH3═N2+6NH4Cl,检查氯气管道是否漏气.下列说法错误的是( )
| A、若管道漏气遇氨就会产生白烟 |
| B、该反应利用了氨气的还原性 |
| C、该反应属于复分解反应 |
| D、生成6mol NH4Cl有6mol电子转移 |
常温下能发生反应的一组气体是( )
| A、H2、CO |
| B、CO2、O2 |
| C、NH3、HCl |
| D、N2、O2 |
下列有关化学用语表达不正确的是( )
A、氨气分子的电子式: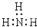 |
| B、CS2分子的结构式:S=C=S |
C、S2-的结构示意图: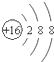 |
D、CH4的分子模型示意图为: |
下列既能与酸反应,又能与碱反应的氧化物是( )
| A、NaHCO3 |
| B、Al2O3 |
| C、CuO |
| D、CO2 |