题目内容
超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:
Al2O3+N2+3C![]() 2AlN+3CO↑
2AlN+3CO↑
由于反应不完全,氮化铝产品中往往含有碳和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
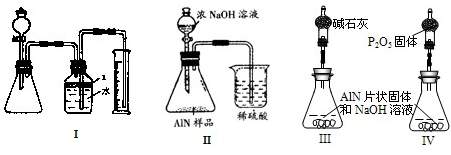
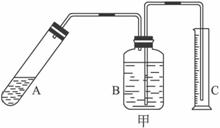
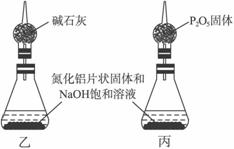
(1)称取20.00 g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气6.72 L(标准状况)。
①上述反应的化学方程式为_____________________________________________________;
②该产品中AlN的质量分数为_______________________________。
(2)另取10.00 g样品置于反应器中,通入2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34 g·L-1(已折算成标准状况,AlN不跟O2反应)。该产品中含杂质碳__________g。(此问需写出计算过程)
(1)①AlN+NaOH+H2O====NaAlO2+NH3↑
②61.5%
(2)m(C)=1.92 g 计算过程见解析。
解析:
(2)O2+2C![]() 2CO O2+C
2CO O2+C![]() CO2
CO2
![]() (气体)=1.34 g·L-1×22.4 L·mol-1=30.0 g·mol-1
(气体)=1.34 g·L-1×22.4 L·mol-1=30.0 g·mol-1
28<30.0<44
即Mr(CO)<![]() (气体)<Mr(CO2)
(气体)<Mr(CO2)
故反应后得到的气体是CO和CO2的混合气体。
设混合气体中CO2的物质的量为x,CO的物质的量为y。
2x+y=![]() ×2 (氧原子守恒)
×2 (氧原子守恒)
![]() =30.0 g·mol-1
=30.0 g·mol-1
解得:x=0.02 mol y=0.14 mol
所以:m(C)=12 g·mol-1×(0.02 mol+0.14 mol)=1.92 g

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目