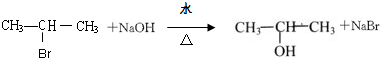
题目内容
14.已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.请填写下列空白.
(1)E元素基态原子的核外电子排布式为1s22s22p63s23p63d104s1.
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为C<O<N(填元素符号),其原因为同周期随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,其第一电离能大于氧元素.
(3)B2A4是重要的基本石油化工原料.B2A4分子中B原子轨道的杂化类型为sp2;1mol B2A4分子中含5molσ键.
(4)已知D、E能形成晶胞如图所示的两种化合物
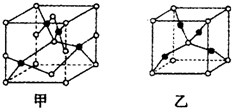 ,化合物的化学式,甲为CuO,乙为Cu2O;高温时,甲易转化为乙的原因为Cu2O中Cu原子d轨道为全满状态,比较稳定.
,化合物的化学式,甲为CuO,乙为Cu2O;高温时,甲易转化为乙的原因为Cu2O中Cu原子d轨道为全满状态,比较稳定.
分析 A、B、C、D、E五种元素的原子序数依次增大,A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,则B原子核外有6个电子,则B为C元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为O元素;C的原子序数介于碳、氧元素之间,则C为N元素;E+原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为2+8+18+1=29,则E为Cu元素,据此进行解答.
解答 解:A、B、C、D、E五种元素的原子序数依次增大,A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,则B原子核外有6个电子,则B为C元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为O元素;C的原子序数介于碳、氧元素之间,则C为N元素;E+原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为2+8+18+1=29,则E为Cu元素,
(1)E为Cu元素,基态原子的核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)同周期,随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,能量较低,失去第一个电子需要的能量较多,其第一电离能高于同周期相邻元素,故C、N、O三种元素的第一电离能数值由小到大的顺序为C<O<N,
故答案为:C<O<N;同周期随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,其第一电离能大于氧元素;
(3)C2H4分子中C原子有3个σ键,无孤电子对,轨道的杂化类型为sp2杂化,1个C2H4分子中含有5个σ键,1个1个π键,lmolC2H4分子中σ键5mol,
故答案为:sp2;5;
(4)已知O、Cu能形成晶胞如图所示的两种化合物,甲中黑色球数目=4,白色球数目=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,Cu、O原子数目之比为1:1,则甲的化学式为CuO,乙中黑色球数目=4,白色球数目=1+8×$\frac{1}{8}$=2,黑色球与白色球个数之比为2:1,氧元素为-2价,则乙的化学式为Cu2O,Cu2O中Cu原子d轨道为全满状态,比较稳定,故高温时甲易转化为乙,
故答案为:CuO;Cu2O;Cu2O中Cu原子d轨道为全满状态,比较稳定.
点评 本题综合考查物质结构与性质,涉及元素推断、核外电子排布、电离能、杂化轨道、化学键、晶胞计算等,推断元素是解题关键,(4)中从结构分析氧化铜高温转化为氧化亚铜为易错点、难点,难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
(1)装置A可用于制备多种气体,请写出用A装置制备下列气体时,圆底烧瓶和分液漏斗中应装的化学试剂
| 气体 | O2 | CO2 | HCl |
| 试剂 |
(3)现要用上述装置制取Cl2,并设计实验比较Cl2和I2的氧化性强弱,请在表格内依次填上所需的装置和试剂(可不填满)
| 装置 | 该装置中反应的离子方程式 |
| A. | FeCl2 | B. | CuCl2 | C. | FeCl3 | D. | AlCl3 |
| A. | 二氧化硅可用来制造石英光导纤维 | |
| B. | 亚硫酸钠可用于防止食品氧化变质,延长食品的保质期 | |
| C. | 碳酸氢钠俗名苏打,可用于制作发酵粉和治疗胃酸过多的药物 | |
| D. | 三氧化二铁常用作红色油漆和涂料 |
| A. | 氧化物:CO2NO SO2H2O | |
| B. | 碱:NaOH KOH Ba(OH)2Na2CO3 | |
| C. | 铵盐:NH4Cl NH4NO3(NH4)2SO4NH3-H2O | |
| D. | 碱性氧化物:Na2O CaO Mn2O7 Al2O3 |
| A. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]>c[(NH4)2SO4]>c(NH4Cl) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 等的物质的量的CH3COOH和CH3COONa的混合溶液:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1 mol•L-1 pH=4的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) |