题目内容
20.用式量是57的烃基取代甲苯苯环上的一个氢原子,能得到的有机物种数为( )| A. | 4种 | B. | 8种 | C. | 12种 | D. | 24种 |
分析 根据烷基组成通式结合式量为57的确定烷基,再根据烷烃的同分异构体中等效氢确定烷基同分异构体数目,利用等效H判断甲苯苯环上的H原子种类有3种(邻、间、对),再利用组合计算判断.
解答 解:烷基组成通式为CnH2n+1,烷基式量为57,所以14n+1=57,解得n=4,所以烷基为-C4H9,
若为正丁烷形成的丁基,正丁烷分子中有2种H原子,形成的丁基有2种结构,
若为异丁烷形成的丁基,异丁烷分子中有2种H原子,形成的丁基有2种结构,
故丁基共有4种结构,
甲苯苯环上的H原子种类有3种,故丁基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为4×3=12,
故选:C.
点评 本题主要考查同分异构体的书写,难度中等,关键根据烷基式量为57的确定烷基,注意利用等效氢判断可能的烷基异构情况与苯环中氢原子种类.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列叙述中,正确的是( )
| A. | 乙醛与银氨溶液水浴共热,发生还原反应得到光亮如镜的银 | |
| B. | 苯乙烯与氢气在合适条件下,发生加成反应生成乙基环己烷 | |
| C. | 乙醇与浓硫酸共热迅速升温至140℃时,发生消去反应生成乙烯 | |
| D. | 甲苯与氯气在光照下,发生取代反应主要生成2,4二氯甲苯 |
17.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=a kJ•mol一1
CH3OH(l)=CH4(g)+$\frac{1}{2}$O2(g)△H=b kJ•mol一1
CO2(g)+2H2O(g)=CH3OH(l)+$\frac{3}{2}$O2(g)△H=+638.5 kJ•mol一1
则下列叙述正确的是( )
CH3OH(l)=CH4(g)+$\frac{1}{2}$O2(g)△H=b kJ•mol一1
CO2(g)+2H2O(g)=CH3OH(l)+$\frac{3}{2}$O2(g)△H=+638.5 kJ•mol一1
则下列叙述正确的是( )
| A. | 甲烷的燃烧热为a kJ•mol-1 | B. | a一定大于0 | ||
| C. | a+b=-638.5 | D. | b一定小于0 |
15.W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示.
(1)W2与Z2反应化合物甲,W2与Q2反应生成化合物乙.已知反应:
乙(g)+Z2(g)→甲(g)+Q2(g),每生成1mol Q2放热57.8kJ.写出该反应的热化学方程式:2HCl(g)+$\frac{1}{2}$O2(g)=H2O(g)+Cl2(g)△H=-57.8 kJ/mol或4HCl(g)+O2(g)=2H2O(g) 2Cl2(g)△H=-115.6 kJ/mol;
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式说明)NH4++H2O?NH3.H2O+H+;该溶液中各种离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(3)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:
2CO+2NO N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
(4)将1mol丙气体和1mol丁气体充入装有催化剂的恒压容器中,充分反应达平衡后:①若气体体积较原来减少23%,则丁的转化率为92%;
②已知该反应△H<0,则升高温度,平衡常数K值将变小(填变大、变小或不变);
③若仅将压强增大为原来的2倍,再次达平衡后,混合气体中丁的体积分数将变小(填变大、变小或不变).
(5)由X的最简单气态氢化物、Z的单质和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为CH4+10OH--8e-=CO32-+7H2O.
| X | ||
| M |
乙(g)+Z2(g)→甲(g)+Q2(g),每生成1mol Q2放热57.8kJ.写出该反应的热化学方程式:2HCl(g)+$\frac{1}{2}$O2(g)=H2O(g)+Cl2(g)△H=-57.8 kJ/mol或4HCl(g)+O2(g)=2H2O(g) 2Cl2(g)△H=-115.6 kJ/mol;
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式说明)NH4++H2O?NH3.H2O+H+;该溶液中各种离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(3)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:
2CO+2NO
 N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;(4)将1mol丙气体和1mol丁气体充入装有催化剂的恒压容器中,充分反应达平衡后:①若气体体积较原来减少23%,则丁的转化率为92%;
②已知该反应△H<0,则升高温度,平衡常数K值将变小(填变大、变小或不变);
③若仅将压强增大为原来的2倍,再次达平衡后,混合气体中丁的体积分数将变小(填变大、变小或不变).
(5)由X的最简单气态氢化物、Z的单质和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为CH4+10OH--8e-=CO32-+7H2O.
5.下列叙述正确的是( )
| A. | 同主族元素从上到下,元素原子得电子能力逐渐减弱,表现在氢化物的稳定性逐渐增强 | |
| B. | 除稀有气体元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大 | |
| C. | 化学反应的过程中一定伴随着热量的变化 | |
| D. | 在主族元素中,最外层电子数少的元素原于一定比最外层电子数多的元素原子失电子能力强 |
12.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | 离子半径:r(Y2-)>r(Z2+) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物弱 | |
| D. | X、Y、Z、W所有元素的最高正价等于其所在族的族序数 |

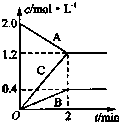 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答: