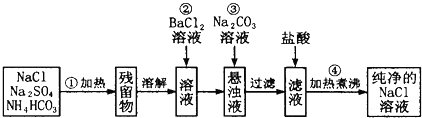
题目内容
【题目】将64g铜与一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为33.6L.欲使反应生成的气体在NaOH溶液中全部转化为NaNO3 , 至少需要40%的双氧水的质量为( )
A.85g
B.79g
C.116g
D.58g
【答案】A
【解析】解:Cu与硝酸反应得到硝酸铜与NO和NO2混合气体,NO和NO2混合气体再在双氧水、碱性条件下转化为NaNO3 , 纵观整个过程,根据电子转移守恒,Cu提供的电子等于过氧化氢获得的电子,
64g铜的物质的量= ![]() =1mol,故Cu提供电子为1mol×2=2mol,故需要过氧化氢的物质的量=
=1mol,故Cu提供电子为1mol×2=2mol,故需要过氧化氢的物质的量= ![]() =1mol,过氧化氢的质量=1mol×34g/mol=34g,需要40%的双氧水的质量=
=1mol,过氧化氢的质量=1mol×34g/mol=34g,需要40%的双氧水的质量= ![]() =85g,故选A.
=85g,故选A.

【题目】某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3溶液的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T(K) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (I)实验①和②探究HNO3浓度对该反应速率的影响 (II)实验①和____探究温度对该反应速率的影响; (III)实验①和____探究大理石规格(粗、细)对该反应速率的影响。 |
② | _____ | _______ | __________ | |
③ | _____ | _______ | __________ | |
④ | _____ | _______ | __________ |
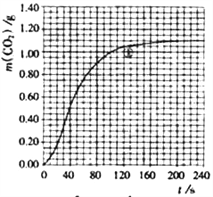
(2)实验①中CO2质量随时间变化的关系见下图:依据反应方程式![]() CaCO3+HNO3=
CaCO3+HNO3=![]() Ca(NO3)2+
Ca(NO3)2+![]() CO2↑+
CO2↑+![]() H2O,计算实验①在70-90 s范围内HNO3的平均反应速率____________,写出计算过程[忽略溶液体积变化,且70s时m(CO2)=0.84g,90s时m(CO2)=0.95g]。
H2O,计算实验①在70-90 s范围内HNO3的平均反应速率____________,写出计算过程[忽略溶液体积变化,且70s时m(CO2)=0.84g,90s时m(CO2)=0.95g]。