题目内容
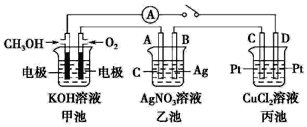
【题目】如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氧气的电极为_____________ (填“正极”或“负极”),负极的电极反应式为________________________________________ 。
(2)石墨电极为__________(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,__________ 区(填“铁极”或“石墨极”)的溶液先变红。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________________,填“增大”“减 小”或“不变”)。精铜电极上的电极反应式为_______________________。
(4)若在标准状况下,有224m L氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为_________L;丙装置中阴极析出铜的质量为 ____________g 。
【答案】正极 CH3OCH3-12e-+16OH-═2CO32-+11H2O 阳极 铁极 减少 Cu2+ + 2e- = Cu 0.448 1.28
【解析】
(1)原电池中,正极发生还原反应,负极发生氧化反应,负甲醚失去电子被氧化生成碳酸根离子;
(2)铁电极连接原电池的负极,为电解池的阴极,阴极上氢离子放电;
(3)根据转移电子守恒,阳极上铜消耗的质量小于阴极上析出铜的质量,所以溶液中硫酸铜浓度减小;
(4)根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2~2H2~2Cu进行计算。
(1)燃料电池中通入氧化剂氧气的电极是正极,正极上得电子发生还原反应,负极上通入的是甲醚,负极上燃料失电子和氢氧根离子发生氧化反应生成碳酸根离子和水,电极反应式为:CH3OCH3-12e-+16OH-═2CO32-+11H2O,故答案为:正极;CH3OCH3-12e-+16OH-═2CO32-+11H2O。
(2)铁电极连接原电池负极而作电解池阴极,碳作阳极,电解氯化钠饱和溶液时,阳极上氯离子放电,电极反应式为2Cl--2e-=Cl2↑,阴极上氢离子放电,电极方程式为:2H2O+2e-=2OH-+H2↑,滴入酚酞溶液,铁电极区的溶液先变红,
故答案为:阳极,铁极。
(3)丙装置中,如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌、银失去电子进入溶液,阴极上析出铜离子,阳极上金属失电子发生氧化反应,电极方程式为:Cu2++2e-=Cu,阴极上铜离子得电子生成铜,根据转移电子守恒,阳极上铜消耗的质量小于阴极上析出铜的质量,所以溶液中硫酸铜浓度减小,故答案为:减少,Cu2++2e-=Cu。
(4)根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2~2H2~2Cu。若在标准状况下,有224mL的氧气参加反应,乙装置中铁电极上氢离子放电生成氢气,则乙装置中铁电极上生成氢气的体积=0.224L×2=0.448L,丙装置中阴极上铜离子得电子生成铜单质,析出铜的质量=0.224L/22.4L/mol×2×64g/mol=12.8g,
故答案为:0.448L,12.8g。

【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到______(填仪器名称)中定容,摇匀即得.
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_______作指示剂.
(3)读取盛装0.1000mol/L KOH溶液的_________(填仪器名称)的初始读数.如果液面位置如图所示,则此时的读数为________mL.

(4)滴定:当_______时,停止滴定,并记录KOH溶液的终点读数.重复滴定3次.
Ⅱ.实验记录:
实验数据(mL) 滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(KOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=______g/100mL.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是____(填写序号)。
A.碱式滴定管在滴定时未用标准KOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出