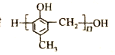
题目内容
【题目】现有阳离子交换膜(只允许阳离子通过)、阴离子交换膜(只允许阴离子通过)、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换技术原理,可电解Na2SO4溶液生产NaOH和H2SO4溶液。下列说法正确的是

A. 阳极反应式为2H++2e-===H2↑
B. 从D口出来的是NaOH溶液
C. 阴极区pH降低
D. 当电路中通过2mol电子的电量时,会有1mol的O2生成
【答案】B
【解析】A、阳极是氢氧根离子放电,阳极发生的反应为:2H2O﹣4e﹣═O2↑+4H+,选项A错误;B、阴极附近时H+放电生成氢气,氢氧根离子浓度增大,在阴极一侧放置阳离子交换膜,只允许通过阳离子钠离子,故从D口出来的是NaOH溶液,选项B正确;C、阴极附近时H+放电生成氢气,氢氧根离子浓度增大,PH升高,选项C错误;D、根据阳极发生的反应:2H2O﹣4e﹣═O2↑+4H+,当电路中通过2mol电子的电量时,会有0.5mol的O2生成,选项D错误。答案选B。

【题目】乙醛酸(OHC-COOH)是合成名贵香料的原料之一。
I.由乙二醛催化氧化制乙醛酸的反应如下:2OHC-CHO(g)+O2(g) ![]() 2OHC-COOH(g)△H
2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表1:
化学键 | O=O | C-O | O-H | C-H |
键能(KJ/mol) | 498 | 351 | 465 | 413 |
计算上述反应的△H=____________kJ·mol-1。
(2)一定条件下,按照![]() 投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图所示。
投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图所示。

①该反应在A点放出的热量________B点放出的热量(填“>”、“=”或“<”)
②某同学据图推知,生成乙醛酸的速率:v(A)>v(B),你认为此结论是否正确,简述理由__________。
③图中A点时,乙醛酸的体积分数为_____________。
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有__________ (列举一条)。
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如图所示。
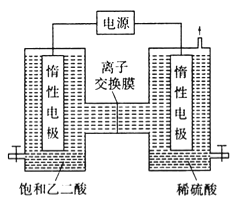
(1)图中的离子交换膜为___________ (填“阳”或“阴”)膜。
(2)稀硫酸的作用为____________。
(3)生成乙醛酸的电极反应式为_______________。
【题目】将金属钙置于空气中充分燃烧,然后向所得固体产物中加入一定量蒸馏水,观察到剧烈反应,产生大量的热,并且放出有臭味的气体。对此,化学兴趣小组的同学们在老师的指导下进行了探究。
【査阅资料】①Mg在氮气中燃烧生成氮化镁(Mg3N2),氮化镁与水发生复分解反应,有NH3生成。
②CaO2遇水反应生成H2O2,H2O2会分解产生一定量的O3。
③碘量法是最常用的臭氧测定方法,其原理为:O3+2KI+H2O=O2+I2+2K0H
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性,因此可以推断Ca在空气燃烧时,能与空气中的氮气反应生成________。
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧也有CaO2生成,其化学方程式为:________。
(3)丙同学对臭味气体的成分提出三种假设。
【提出假设】假设1:产生臭味的气体只是O3;
假设2:产生臭味的气体只是_______________;
假设3:产生臭味的气体是____________________。
【实验探究】为此,同学们对臭味气体的成分进行了实验探究。实验室提供的实验试剂有:红色石蕊试纸、蓝色石蕊试纸、淀粉-KI试纸、蒸馏水。
请按下列表格填写完成实验操作、与结论相应的预期现象:
实验操作 | 预期现象 | 结论 |
取少量钙在空气中充分燃烧后的 固体产物于试管中,加少量蒸熘水,分别用________、________在短时间内快速检测产生的气体。 | __________ | 假设1成立 |
__________ | 假设2成立 | |
_________ | 假设3成立 |