题目内容
(14分)
“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)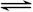 1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
_______________________________________________________________________。
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:___________________________________。
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为______________mol。

(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH——4e— = O2↑+2H2O,则阴极反应为:____________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?_______,理由是:___________________________________。
“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)
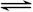 1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
_______________________________________________________________________。
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
燃料电池放电时的负极反应为:___________________________________。
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为______________mol。

(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH——4e— = O2↑+2H2O,则阴极反应为:____________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行?_______,理由是:___________________________________。
(1)2N2H4(g) + N2O4(g)=3N2(g) + 4H2O(g) △H = -1083.0 kJ·mol-1(4分)
(2)H2-2e-+2OH-=2H2O (2分) 2 (2分)
(3)2CO2+4e-+2H2O=2CO+4OH-(2分)
不能(2分) △H>0,吸热,△S<0(2分)
(2)H2-2e-+2OH-=2H2O (2分) 2 (2分)
(3)2CO2+4e-+2H2O=2CO+4OH-(2分)
不能(2分) △H>0,吸热,△S<0(2分)
(1)考查盖斯定律的应用。根据①N2(g) + 2O2(g) =2NO2(g)、②N2H4(g) + O2(g) =N2(g) + 2H2O(g)和③NO2(g) 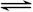 1/2N2O4(g)可知,如果②×2-①-③×2即得到2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),所以反应热为-534.0 kJ/mol×2-67.7 kJ/mol+26.35 kJ/mol×2="-1083.0" kJ/mol。
1/2N2O4(g)可知,如果②×2-①-③×2即得到2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),所以反应热为-534.0 kJ/mol×2-67.7 kJ/mol+26.35 kJ/mol×2="-1083.0" kJ/mol。
(2)在原电池中负极失去电子,发生氧化反应,所以氢气通入负极,反应式为H2-2e-+2OH-=2H2O。水电解生成氢气和氧气,体积之比是2︰1。即氢气是22.4L,物质的量为1.0mol,所以转移的电子是2.0mol。
(3)在原电池中负极和正极的电极反应式相叠加即得到总反应式,所以根据总反应式和阳极(即负极)反应式可得到阴极(即正极)反应式为2CO2+4e-+2H2O=2CO+4OH-。由于反应2CO=2C+O2是吸热的,熵值减小的反应,所以是不能自发进行的。
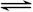 1/2N2O4(g)可知,如果②×2-①-③×2即得到2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),所以反应热为-534.0 kJ/mol×2-67.7 kJ/mol+26.35 kJ/mol×2="-1083.0" kJ/mol。
1/2N2O4(g)可知,如果②×2-①-③×2即得到2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),所以反应热为-534.0 kJ/mol×2-67.7 kJ/mol+26.35 kJ/mol×2="-1083.0" kJ/mol。(2)在原电池中负极失去电子,发生氧化反应,所以氢气通入负极,反应式为H2-2e-+2OH-=2H2O。水电解生成氢气和氧气,体积之比是2︰1。即氢气是22.4L,物质的量为1.0mol,所以转移的电子是2.0mol。
(3)在原电池中负极和正极的电极反应式相叠加即得到总反应式,所以根据总反应式和阳极(即负极)反应式可得到阴极(即正极)反应式为2CO2+4e-+2H2O=2CO+4OH-。由于反应2CO=2C+O2是吸热的,熵值减小的反应,所以是不能自发进行的。

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目