题目内容
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。
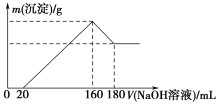
(1)加入NaOH溶液0~20 mL时的反应的离子方程式为________________,160~180 mL时的反应的离子方程式为____________________________。
(2)合金中Mg的质量为________g,所用HCl的物质的量浓度为________mol/L。
【答案】H++OH-===H2O Al(OH)3+OH-===AlO![]() +H2O )4.8 8
+H2O )4.8 8
【解析】
(1)由题图可知,加入NaOH溶液的体积小于20 mL时,没有沉淀生成,说明原溶液中溶解Mg、Al后,盐酸有剩余,则发生的反应为HCl+NaOH=NaCl+H2O;继续滴加NaOH溶液至160 mL时,沉淀量最大,沉淀为Mg(OH)2和Al(OH)3,溶液为NaCl溶液;再继续滴加NaOH溶液,发生反应:Al(OH)3+NaOH=NaAlO2+2H2O。
(2)由题图可知,产生沉淀的过程中消耗氢氧化钠溶液140 mL,由OH-守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16 L-0.02 L)×5 mol/L=0.7 mol;溶解Al(OH)3的过程中发生反应Al(OH)3+NaOH=NaAlO2+2H2O,消耗氢氧化钠溶液20 mL,所以n[Al(OH)3]=(0.18 L-0.16 L)×5mol/L=0.1 mol,故n[Mg(OH)2]=0.2 mol,由原子守恒可知n(Mg)=n[Mg(OH)2]=0.2 mol,所以Mg的质量为0.2 mol×24 g/mol=4.8 g。加入氢氧化钠溶液为160 mL时,沉淀量最大,溶液为氯化钠溶液,根据钠原子守恒,溶液中n(NaCl)=n(NaOH)=0.16 L×5 mol/L=0.8 mol,根据氯原子守恒n(HCl)=n(NaCl)=0.8 mol,故HCl的物质的量浓度为![]() =8 mol/L。
=8 mol/L。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案