题目内容
【题目】三氯氧磷(POCl3)广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。回答下列问题:
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为_______
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为_______
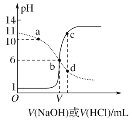
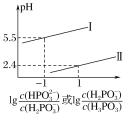
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg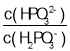 的是曲线_____(填“Ⅰ”或“Ⅱ”),亚磷酸(H3PO3)的Ka1=_____,反应HPO32-+H2O
的是曲线_____(填“Ⅰ”或“Ⅱ”),亚磷酸(H3PO3)的Ka1=_____,反应HPO32-+H2O![]() H2PO3-+OH-的平衡常数的值是_____。
H2PO3-+OH-的平衡常数的值是_____。
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=_____ mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)![]()
【答案】PCl3+H2O+Cl2![]() POCl3+2HCl c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+) Ⅰ 10-1.4 10-7.5 4×10-7
POCl3+2HCl c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+) Ⅰ 10-1.4 10-7.5 4×10-7
【解析】
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,三氯氧磷为POCl3,实际上为PCl3与Cl2反应生成PCl5,PCl5水解生成POCl3;
(2)亚磷酸(H3PO3)为二元弱酸,则HPO32-不能再发生电离,只能水解,使溶液呈碱性,据此分析;
(3)根据H3PO3的电离平衡常数,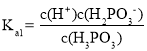 ,
,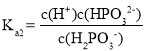 ,则
,则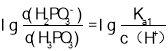 ,
,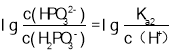 所以图象关系可表示为:pH=
所以图象关系可表示为:pH=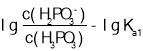 ,pH=
,pH=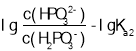 ,据此分析;
,据此分析;
(4)根据CaSO4的溶度积常数计算。
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,三氯氧磷为POCl3,实际上为PCl3与Cl2反应生成PCl5,PCl5水解生成POCl3,发生的化学反应为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)亚磷酸(H3PO3)为二元弱酸,则HPO32-不能再发生电离,只能水解,使溶液呈碱性,同时考虑到水也存在电离平衡,所以溶液中c(H2PO3-)<c(OH-),因此溶液中离子浓度大小顺序为:c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+),故答案为:c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+);
(3)根据H3PO3的电离平衡常数,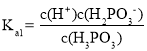 ,
,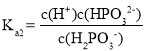 ,则
,则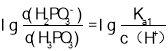 ,
,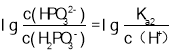 所以图象关系可表示为:pH=
所以图象关系可表示为:pH=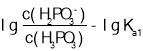 ,pH=
,pH=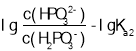 ,由于Ka1>Ka2,所以表示
,由于Ka1>Ka2,所以表示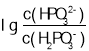 的图形,纵截距更大,根据图像,则表示
的图形,纵截距更大,根据图像,则表示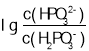 的图线为曲线Ⅰ,当溶液中
的图线为曲线Ⅰ,当溶液中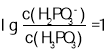 时,pH=2.4,所以
时,pH=2.4,所以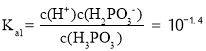 ,反应
,反应![]() 的平衡常数
的平衡常数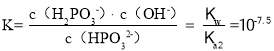 ,故答案为:Ⅰ;10-1.4;10-7.5;
,故答案为:Ⅰ;10-1.4;10-7.5;
(4))处理后的废水中c(Ca2+)=5×10-6mol/L,则溶液中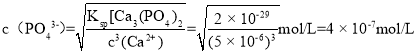 ,故答案为:4×10-7。
,故答案为:4×10-7。

【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D