题目内容
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
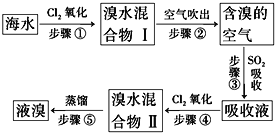
(1)步骤①反应的离子方程式是_______________________________________,
步骤③反应的化学方程式是_______________________________________。
(2)从理论上考虑,下列物质也能吸收Br2的是________________。
A.NaOH B.FeCl2
C.Na2SO3 D.H2O
(3)步骤③中氧化剂是____________,若反应中生成2 mol HBr,则消耗________mol SO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是_______________。
【答案】 2Br-+Cl2===Br2+2Cl- SO2+Br2+2H2O===H2SO4+2HBr A、B、C Br2 1 Cl2>Br2>SO2
【解析】(1)步骤①发生氯气氧化溴离子,反应的离子方程式是2Br-+Cl2=Br2+2Cl-,步骤③发生溴氧化二氧化硫,反应的化学方程式是SO2+Br2+2H2O=H2SO4+2HBr。(2)A.NaOH能与单质溴反应,A正确;B.FeCl2能被溴氧化,B正确;C.Na2SO3能被溴氧化,C正确;D.溴在水中的溶解性较小,不能用水吸收溴,D错误,答案选ABC;(3)步骤③中反应的化学方程式是SO2+Br2+2H2O=H2SO4+2HBr,其中Br元素化合价降低,氧化剂是Br2,若反应中生成2 mol HBr,则消耗1mol SO2。(4)氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,则根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是Cl2>Br2>SO2。

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】将0.2molL-1的的KI溶液和0.05 molL-1Fe2(SO4)3溶液等体枳混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-![]() 2 Fe2++I2的组合是
2 Fe2++I2的组合是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和② B. ②和③ C. ③和④ D. ①
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为 。
② 下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是 (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
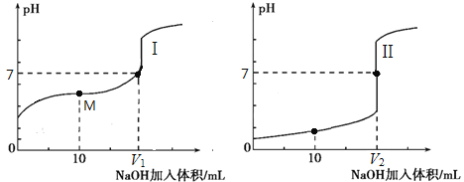
滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a ,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
写出步骤2中溶液变红色的离子方程式 。
步骤3中现象a是 。
用化学平衡原理解释步骤4的实验现象 。


