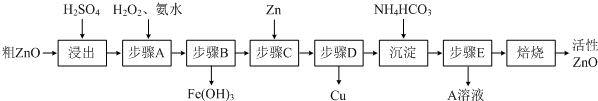
题目内容
(2011?广东模拟)苯酚是重要的化工原料,通过下列流程可合成阿司匹林(乙酰水杨酸)、香料、和一些高分子化合物.
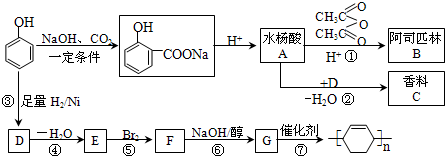
根据上面的流程图,回答下列问题:
(1)写出香料C的结构简式: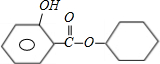
 .
.
(2)写出反应类型:④
(3)写出下列反应的化学方程式:
①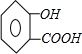 +
+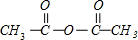
 +H2O
+H2O +
+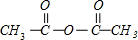
 +H2O;⑥
+H2O;⑥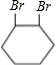 +2NaOH
+2NaOH
 +2NaBr+2H2O
+2NaBr+2H2O +2NaOH
+2NaOH
 +2NaBr+2H2O.
+2NaBr+2H2O.
(4)下列试剂中,可检验阿司匹林样品中混有水杨酸的是
A.三氯化铁溶液B.碳酸氢钠溶液C.石蕊试液 D.金属钠.

根据上面的流程图,回答下列问题:
(1)写出香料C的结构简式:


(2)写出反应类型:④
消去反应
消去反应
、⑦加聚反应
加聚反应
.(3)写出下列反应的化学方程式:
①
 +
+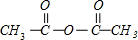
| H+ |
 +H2O
+H2O +
+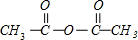
| H+ |
 +H2O
+H2O +2NaOH
+2NaOH| 醇 |
| △ |
 +2NaBr+2H2O
+2NaBr+2H2O +2NaOH
+2NaOH| 醇 |
| △ |
 +2NaBr+2H2O
+2NaBr+2H2O(4)下列试剂中,可检验阿司匹林样品中混有水杨酸的是
A
A
.A.三氯化铁溶液B.碳酸氢钠溶液C.石蕊试液 D.金属钠.
分析:反应③苯酚与足量氢气发生加成反应环己醇,则D为 ,
, 发生消去反应生成E,E为
发生消去反应生成E,E为 ,与溴发生加成反应生成F,F为
,与溴发生加成反应生成F,F为 ,
, 发生消去反应生成G,G为
发生消去反应生成G,G为 ,
, 发生加聚反应生成
发生加聚反应生成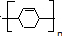 ,A是水杨酸为
,A是水杨酸为 ,
, 与
与 发生酯化反应生成C,C为
发生酯化反应生成C,C为 ,B是阿司匹林为
,B是阿司匹林为 ,结合有机物的结构和性质解答该题.
,结合有机物的结构和性质解答该题.
 ,
, 发生消去反应生成E,E为
发生消去反应生成E,E为 ,与溴发生加成反应生成F,F为
,与溴发生加成反应生成F,F为 ,
, 发生消去反应生成G,G为
发生消去反应生成G,G为 ,
, 发生加聚反应生成
发生加聚反应生成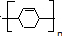 ,A是水杨酸为
,A是水杨酸为 ,
, 与
与 发生酯化反应生成C,C为
发生酯化反应生成C,C为 ,B是阿司匹林为
,B是阿司匹林为 ,结合有机物的结构和性质解答该题.
,结合有机物的结构和性质解答该题.解答:解:反应③苯酚与足量氢气发生加成反应环己醇,则D为 ,
, 发生消去反应生成E,E为
发生消去反应生成E,E为 ,与溴发生加成反应生成F,F为
,与溴发生加成反应生成F,F为 ,
, 发生消去反应生成G,G为
发生消去反应生成G,G为 ,
, 发生加聚反应生成
发生加聚反应生成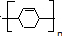 ,A是水杨酸为
,A是水杨酸为 ,
, 与
与 发生酯化反应生成C,C为
发生酯化反应生成C,C为 ,B是阿司匹林为
,B是阿司匹林为 ,则
,则
(1)由以上分析可知,C的结构简式为 ,
,
故答案为: ;
;
(2)反应④为 发生消去反应生成
发生消去反应生成 ,
,
反应⑦是 发生加聚反应生成
发生加聚反应生成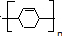 ,
,
故答案为:消去反应,加聚反应;
(3)反应①是水杨酸和乙酸酐发生酯化反应,反应方程式为:
 +
+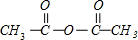
 +CH3COOH,
+CH3COOH,
反应⑥是 发生消去反应生成
发生消去反应生成 ,反应方程式为:
,反应方程式为:
 +2NaOH
+2NaOH
 +2NaBr+2H2O,
+2NaBr+2H2O,
故答案为: +
+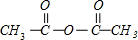
 +CH3COOH;
+CH3COOH;
 +2NaOH
+2NaOH
 +2NaBr+2H2O;
+2NaBr+2H2O;
(4) 中含有酚羟基,可与氯化铁反应生成紫色物质,
中含有酚羟基,可与氯化铁反应生成紫色物质,
故答案为:A.
 ,
, 发生消去反应生成E,E为
发生消去反应生成E,E为 ,与溴发生加成反应生成F,F为
,与溴发生加成反应生成F,F为 ,
, 发生消去反应生成G,G为
发生消去反应生成G,G为 ,
, 发生加聚反应生成
发生加聚反应生成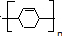 ,A是水杨酸为
,A是水杨酸为 ,
, 与
与 发生酯化反应生成C,C为
发生酯化反应生成C,C为 ,B是阿司匹林为
,B是阿司匹林为 ,则
,则(1)由以上分析可知,C的结构简式为
 ,
,故答案为:
 ;
;(2)反应④为
 发生消去反应生成
发生消去反应生成 ,
,反应⑦是
 发生加聚反应生成
发生加聚反应生成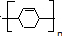 ,
,故答案为:消去反应,加聚反应;
(3)反应①是水杨酸和乙酸酐发生酯化反应,反应方程式为:
 +
+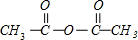
| H+ |
 +CH3COOH,
+CH3COOH,反应⑥是
 发生消去反应生成
发生消去反应生成 ,反应方程式为:
,反应方程式为: +2NaOH
+2NaOH| 醇 |
| △ |
 +2NaBr+2H2O,
+2NaBr+2H2O,故答案为:
 +
+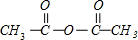
| H+ |
 +CH3COOH;
+CH3COOH; +2NaOH
+2NaOH| 醇 |
| △ |
 +2NaBr+2H2O;
+2NaBr+2H2O;(4)
 中含有酚羟基,可与氯化铁反应生成紫色物质,
中含有酚羟基,可与氯化铁反应生成紫色物质,故答案为:A.
点评:本题考查有机物的推断,涉及酚、醇、羧酸、卤代烃、烯等性质与转化等,题目难度中等,掌握各类有机物的性质是关键,注意反应①根据物质的结构判断反应原理,书写方程式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
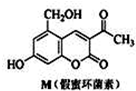 (2011?广东模拟)化合物M叫假蜜环菌甲素,它是香豆素类天然化合物.对M的性质叙述正确的是( )
(2011?广东模拟)化合物M叫假蜜环菌甲素,它是香豆素类天然化合物.对M的性质叙述正确的是( )