题目内容
将等物质的量的HBr和SO2通入水中形成溶液,再向溶液中通入1 mol Cl2,有一半Br-转变为Br2,原混合气体中SO2的物质的量为 ( )
| A.0.8mol | B.1.6mol | C.2mol | D.4mol |
A
HBr的还原性比SO2小,所以,通入1 mol Cl2时,氯气先与二氧化硫反应,二氧化硫反应完全后再与HBr反应;设混合气体中二氧化硫的物质的量为x,由方程式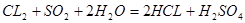 可得,x mol二氧化硫要消耗x mol氯气,由方程式
可得,x mol二氧化硫要消耗x mol氯气,由方程式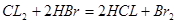 可得,由剩余氯气(1—x) mol要消耗2(1—x) mol的HBr,所以得2(1—x) mol=
可得,由剩余氯气(1—x) mol要消耗2(1—x) mol的HBr,所以得2(1—x) mol=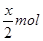 ,得x=0.8mol
,得x=0.8mol
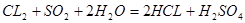 可得,x mol二氧化硫要消耗x mol氯气,由方程式
可得,x mol二氧化硫要消耗x mol氯气,由方程式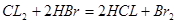 可得,由剩余氯气(1—x) mol要消耗2(1—x) mol的HBr,所以得2(1—x) mol=
可得,由剩余氯气(1—x) mol要消耗2(1—x) mol的HBr,所以得2(1—x) mol=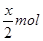 ,得x=0.8mol
,得x=0.8mol
练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
 ;
; 
 ___________________
___________________ _________
_________