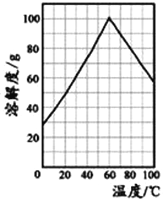
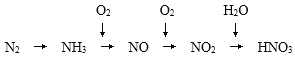题目内容
【题目】写出下列化合物的电子式
(1)K2O_____;
(2)Na2O2_____;
(3)NH4F_____;
(4)Ca(OH)2_____;
(5)CH4_____;
(6)H2O2_____。
【答案】 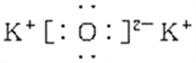

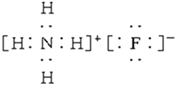
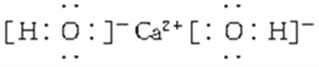


【解析】(1)K2O是离子化合物,由K+和O2-构成,K2O的电子式为![]() ;
;
(2)Na2O2是离子化合物,由Na+和O22-构成,Na2O2的电子式为![]() ;(3)NH4F是离子化合物,由NH4+离子和F-离子构成,NH4F的电子式为
;(3)NH4F是离子化合物,由NH4+离子和F-离子构成,NH4F的电子式为![]() ;(4)Ca(OH)2是离子化合物,由Ca2+离子和OH-离子构成,Ca(OH)2的电子式为
;(4)Ca(OH)2是离子化合物,由Ca2+离子和OH-离子构成,Ca(OH)2的电子式为![]() ;(5)CH4是共价化合物,C原子与4个H原子分别以一对共用电子对结合,电子式为
;(5)CH4是共价化合物,C原子与4个H原子分别以一对共用电子对结合,电子式为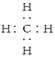 ;(6)H2O2是共价化合物,其结构式为H-O-OH,电子式为
;(6)H2O2是共价化合物,其结构式为H-O-OH,电子式为![]() 。
。

练习册系列答案
相关题目
【题目】已知下列元素的原子半径,根据表中数据推测磷原子的半径可能是
原子 | N | S | O | Si |
半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80×10-10mB.1.10×10-10mC.1.20×10-10mD.0.70×10-10m