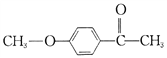
题目内容
【题目】三水乳酸亚铁晶体[(CH3CHOHCOO)2Fe3H2O,Mr=288]是一种很好的补铁剂,易溶于水,吸收效果比无机铁好。可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3== FeCO3↓+Na2SO4
FeCO3+ 2CH3CHOHCOOH ==(CH3CHOHCOO)2Fe+CO2↑+H2O
(1)制备FeCO3时,选用的加料方式是______(填字母),原因是_______________________。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是__________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。
①铁粉的作用是_____________________。
②反应结束后,无需过滤,除去过量铁粉的方法及反应方程式是______________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得三水乳酸亚铁晶体。分离过程中加入无水乙醇的目的是_______________。
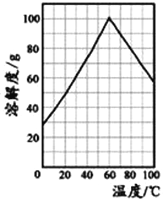
(5)某研究性学习小组从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3) 出发,经过一系列的实验步骤,最后制得到了硫酸亚铁溶液。请结合如图的绿矾溶解度曲线,将FeSO4溶液____________,得到FeSO4·7H2O晶体。
(6)该兴趣小组用标准KMnO4溶液测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数,发现产品的质量分数总是大于100%,其原因可能是____________________。经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000molL-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)219.7mL。滴定反应为Ce4++Fe2+═Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为__________。
【答案】 c 避免生成Fe(OH)2沉淀 取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净 防止+2价的铁元素被氧化 加入适量乳酸让铁粉反应完全,2CH3CHOHCOOH+Fe→(CH3CHOHCOO)2Fe+H2↑ 降低乳酸亚铁在水中的溶解量,有利于晶体析出 加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥 乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大 98.5%
【解析】(1)利用Na2CO3溶液和FeSO4溶液反应制备FeCO3,因为Na2CO3溶液碱性很强,可能会生成Fe(OH)2沉淀,如果将Na2CO3加入FeSO4溶液中, Fe2+是过量的,并且FeSO4溶液为酸性, Fe2+不易沉淀.因此, CO32-容易与Fe2+结合为沉淀析出,因此为避免生成Fe(OH)2沉淀,应将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中.所以c符合要求。因此,本题正确答案是:c 避免生成Fe(OH)2沉淀。
(2)检验洗涤生成的FeCO3沉淀是否完全的方法是:取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(3)因为Fe2+不稳定,容易被氧化,所以加入少量铁粉防止+2价的铁元素被氧化。因为铁的金属性比较活泼,与酸反应能放出氢气。所以可以加入适量乳酸让铁粉反应完全,其反应方程式为:2CH3CHOHCOOH+Fe→(CH3CHOHCOO)2Fe+H2↑。本题答案为:防止+2价的铁元素被氧化;加入适量乳酸让铁粉反应完全,2CH3CHOHCOOH+Fe→(CH3CHOHCOO)2Fe+H2↑。
(4)因为乳酸亚铁不溶于无水乙醇,所以加入无水乙醇的目的是降低乳酸亚铁在水中的溶解量,有利于晶体析出。
(5)由图可知温度为60![]() 时,硫酸亚铁的溶解度最大,0℃时硫酸亚铁的溶解度最小,所以为了得到FeSO4·7H2O晶体应该将溶液加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥即可得到最大量的FeSO4·7H2O晶体。答案:加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥。
时,硫酸亚铁的溶解度最大,0℃时硫酸亚铁的溶解度最小,所以为了得到FeSO4·7H2O晶体应该将溶液加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥即可得到最大量的FeSO4·7H2O晶体。答案:加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥。
(6)由乳酸亚铁晶体的结构简式(CH3CHOHCOO)2Fe知,乳酸亚铁晶体中含有羟基,容易被酸性KMnO4溶液氧化,消耗了KMnO4的用量,导致计算乳酸亚铁晶体的质量分数,总是大于100%。答案:乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大。
由题意知平均消耗0.1000molL-1Ce(SO4)2的体积为19.7mL的物质的量为0.00197mol,根据Ce4++Fe2+═Ce3++Fe3+反应关系知含有Fe2+的物质的量为:0.00197mol。根据(CH3CHOHCOO)2Fe.3H2O的关系知2.880g产品中含量乳酸亚铁晶体的物质的量为:0.00197mol![]() 0.02L×0.1 L=0.00985mol, 产品中乳酸亚铁晶体的质量分数(0.00985mol×288g/mol)/2.880g×100%= 98.5%。答案:98.5%。
0.02L×0.1 L=0.00985mol, 产品中乳酸亚铁晶体的质量分数(0.00985mol×288g/mol)/2.880g×100%= 98.5%。答案:98.5%。

【题目】2017年4月26日,海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+最高能级电子的运动状态有_________种,铬元素在周期表中_____区。
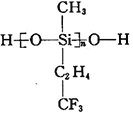
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如下图所示),其中C原子杂化方式为__________杂化。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是__________(填元素符号)
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO3-的空间构型为__________形,写出一个C1O3-的等电子体的化学符号__________________。
③已知高碘酸有两种形式,化学式分别为H5IO6(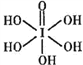 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
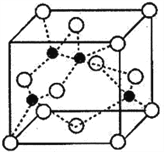
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为______________________。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,该晶体中Zn2+和S2-原子之间的最短距离为体对角线的1/4,则该晶体中S2-和Zn2+之间的最短距离为__________________pm。(写出计算式即可)