题目内容
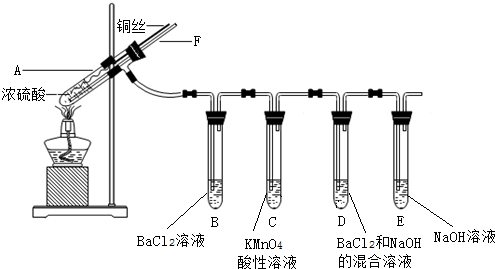
8.某实验小组同学为了探究SO2的性质,进行了如下实验(实验前,装置内空气已排尽):已知:硫酸的沸点是338℃,酒精灯可加热至400℃以上.
主要实验步骤:
①加热试管A直到B、D中均出现大量白色沉淀,熄灭酒精灯;
②将Cu丝上提离开液面;
③从导管F口向装置中通入空气一段时间.
(1)试管A中发生的主要反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)试管B中出现白色沉淀的原因是蒸发出的硫酸与氯化钡反应生成了硫酸钡.
(3)试管C中溶液褪色,说明SO2具有还原性(填“漂白性”或“氧化性”或“还原性”),
请将该反应的离子方程式补充完整:
2MnO4-+5SO2+2H2O=Mn2++5SO42-+4H+
(4)试管D中发生反应的离子方程式为SO2+2OH-+Ba2+=BaSO3↓+H2O.
(5)下列叙述正确的是acd.
a.上下移动铜丝可控制生成SO2的量
b.为确认有CuSO4生成,可向试管A中加水,观察颜色
c.步骤③可使装置中残留气体完全被吸收,避免污染空气
d.熄灭酒精灯后,B中的液体不会倒吸,因为空气可经导管F进入试管A,使压
强平衡
分析 (1)Cu与浓硫酸在加热条件下生成硫酸铜、二氧化硫和水;
(2)加热时少量硫酸挥发进入B中;
(3)高锰酸钾与还原剂反应会褪色;根据化合价升高和降低的相同,以及原子守恒配平;
(4)碱性条件下,二氧化硫与氯化钡反应生成亚硫酸钡沉淀;
(5)a.上下移动铜丝可控制反应的发生和停止;
b.应该把A中的混合物加入水中;
c.通入空气可以把装置中的气体完全排出,被E中溶液吸收;
d.空气能从F管进入A中.
解答 解:(1)Cu与浓硫酸在加热条件下生成硫酸铜、二氧化硫和水,其反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)加热时少量硫酸挥发进入B中,硫酸与B中的氯化钡溶液反应生成硫酸钡,所以B中会生成白色沉淀;
故答案为:蒸发出的硫酸与氯化钡反应生成了硫酸钡;
(3)高锰酸钾与还原剂反应会褪色,C中高锰酸钾溶液褪色,说明二氧化硫与高锰酸钾反应,即二氧化硫有还原性;MnO4-+SO2+=Mn2++SO42-+反应中S的化合价升高2,Mn的化合价降低5,二者的最小公倍数为10,由原子守恒配平方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
故答案为:还原性;2、5、2H2O、2、5、4H+;
(4)碱性条件下,二氧化硫与氯化钡反应生成亚硫酸钡沉淀,则试管D中发生反应的离子方程式为SO2+2OH-+Ba2+=BaSO3↓+H2O;
故答案为:SO2+2OH-+Ba2+=BaSO3↓+H2O;
(5)a.上下移动铜丝可控制反应的发生和停止,所以上下移动铜丝可控制生成SO2的量,故a正确;
b.应该把A中的混合物加入水中,A中含有浓硫酸,不能把水加入浓硫酸中,故b错误;
c.通入空气可以把装置中的气体完全排出,被E中溶液吸收,能防止二氧化硫污染空气,故c正确;
d.因为空气可经导管F进入试管A,使压强平衡,所以熄灭酒精灯后,B中的液体不会倒吸,故d正确;
故答案为:acd.
点评 本题考查浓硫酸的性质及性质实验方案的设计,题目难度中等,明确实验原理是解本题关键,侧重考查学生实验操作、分析能力,知道各个装置目的、作用、发生的反应及实验现象,注意常见化学用语的正确运用.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案| A. | 13.2mol•L-1 | B. | 5.85mol•L-1 | C. | 23.4mol•L-1 | D. | 11.7mol•L-1 |
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p1 原子半径④>①>③>② | |
| B. | 具有下列价电子排布式的原子中,①1s22s22p63s2;②1s22s22p63s23p1;③1s22s2 2p3;④1s22s22p4.第一电离能:③>④>①>② | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ | |
| D. | 某元素气态基态原子的逐级电离能(kJ•mol-1)分别为738、1451、7733、10540、13630、17 995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |
| A. | 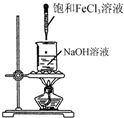 制备氢氧化铁胶体 | B. | 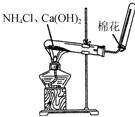 制取NH3 | ||
| C. | 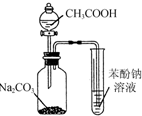 证明H2CO3酸性强于苯酚 | D. | 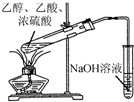 制备乙酸乙酯 |
| A | B | C | D | |
| 实 验 | 用CCl4提取 溴水中的Br2 | 除去乙醇中的苯酚 | 从KI和I2的固体 混合物中回收I2 | 配制100mL 0.1000 mol•L-1 K2Cr2O7溶液 |
| 装 置 或 仪 器 | 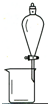 |  |  | 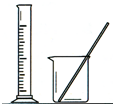 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Al2(SO4)3=2Al3++3SO42- | B. | Na2CO3=Na++CO32- | ||
| C. | Ba(OH)2=Ba2++2 OH- | D. | NaHSO4=Na++H++SO42- |
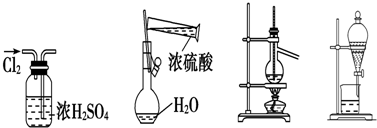
| A. | 干燥Cl2 | B. | 配制硫酸溶液 | C. | 蒸馏 | D. | 分液 |
| A. | 增大SO2的转化率K值一定增大 | B. | 减小压强K值减小 | ||
| C. | 升高温度K值增大 | D. | K值越大SO2转化率越大 |