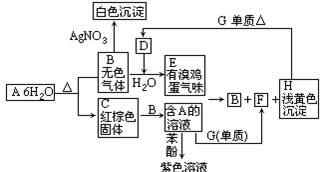
题目内容
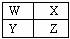
(11分)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y的元素符号是
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键,中心原子杂化轨道类型 ;在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。此反应的化学方程式是 。
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:
_____________________________________________________________________________________________________________________________________。
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键,中心原子杂化轨道类型 ;在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。此反应的化学方程式是 。
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:
_____________________________________________________________________________________________________________________________________。
(1) S (2) 2 ; sp; H- Cl (或H-Z) H- S (或H-Y)
(3)[Ar]3d104s1 (4) 2CO+SO2=S+2CO2
(5)在Na2 S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强。
(3)[Ar]3d104s1 (4) 2CO+SO2=S+2CO2
(5)在Na2 S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强。
根据元素都结构及有关性质可知,X、Y、Z、W分别是C、S、Cl、Cu。
(1)Y是S。
(2)CS2中含有2个碳硫双键,所以分子中含有2个σ键。分子是直线型结构,所以中心原子是sp杂化。氯原子的非金属性强于硫原子的,所以H-Cl键的极性较强。
(3)根据构造原理可知,铜的基态原子核外电子排布式是[Ar]3d104s1。
(4)根据化合价的变化可知,另一种生成物是CO2,所以方程式为
2CO+SO2=S+2CO2。
(5)比较元素的非金属性强弱可以利用单质间的相互置换能力,即在Na2 S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强。
(1)Y是S。
(2)CS2中含有2个碳硫双键,所以分子中含有2个σ键。分子是直线型结构,所以中心原子是sp杂化。氯原子的非金属性强于硫原子的,所以H-Cl键的极性较强。
(3)根据构造原理可知,铜的基态原子核外电子排布式是[Ar]3d104s1。
(4)根据化合价的变化可知,另一种生成物是CO2,所以方程式为
2CO+SO2=S+2CO2。
(5)比较元素的非金属性强弱可以利用单质间的相互置换能力,即在Na2 S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强。

练习册系列答案
相关题目
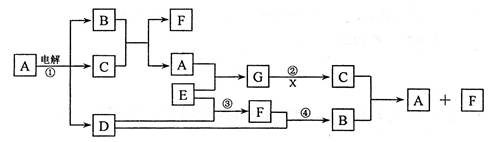
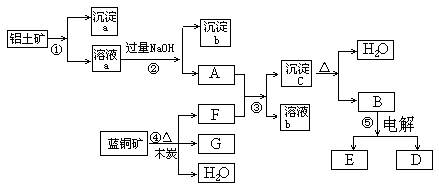
 (2)写出B、C 的最高价氧化物对应的水化物间反
(2)写出B、C 的最高价氧化物对应的水化物间反