题目内容
将一定质量的镁、铝合金投入100 mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5 mol·L-1 NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液体积关系如下图。
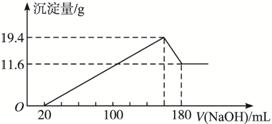
求:(1)原合金中Mg、Al质量各是多少?
(2)盐酸的物质的量浓度。
(1)Mg、Al的质量分别为4.8 g、2.7 g。
(2)盐酸的物质的量浓度为8 mol·L-1
解析:
(1)由图知:沉淀先生成后溶解的是Al(OH)3,质量是(19.4-11.6) g=7.8 g,即0.1 mol,对应的铝也是0.1 mol,质量是2.7 g。其余的11.6 g沉淀应为Mg(OH)2,物质的量为0.2 mol,对应的镁也是0.2 mol,质量是4.8 g。(2)溶解金属消耗的盐酸是0.1 mol×3+0.2 mol×2=0.7 mol剩余的盐酸消耗了 20 mL 5 mol·L-1 NaOH溶液,物质的量是5 mol·L-1×0.02 L=0.1 mol,所以盐酸总的物质的量是0.7 mol+0.1 mol=0.8 mol,可得盐酸的物质的量浓度c=0.8 mol/0.1 L=8 mol·L-1。
解:Mg、Al在整个反应中的变化过程为:
Mg ~ MgCl2 ~ Mg(OH)2 Al ~ AlCl3 ~ Al(OH)3 ~ NaAlO2
24 g 1mol 58g 27 g 1 mol 78 g
m(Mg) n(MgCl2) 11.6 g m(Al) n(AlCl3) 19.4 g-11.6 g
m(Mg)=4.8 g
n(MgCl2)=0.2 mol m(Al)=2.7 g n(AlCl3)=0.1 mol
根据Cl-守理可得:n(HCl)=n(Cl-)=n(MgCl2)×2+n(AlCl3)×3+0.1 mol
=0.2 mol×2+0.1 mol×3+0.1 mol=0.8 mol
c(HCl)=![]() =8 mol·L-1
=8 mol·L-1

 将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积的关系如图,回答下列问题:
将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积的关系如图,回答下列问题:

