题目内容
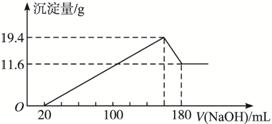
 将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积的关系如图,回答下列问题:
将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积的关系如图,回答下列问题:(1)写出Al与NaOH溶液反应的离子方程式:
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)计算原合金中镁、铝的质量(请写出具体的计算过程,计算结果保留一位小数)
m(Mg)=4.8g,m(Al)=2.7g
m(Mg)=4.8g,m(Al)=2.7g
.分析:由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.继续滴加NaOH溶液,到沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者质量之和为19.4g,溶液为氯化钠溶液.再继续滴加NaOH溶液,到沉淀量开始进行,到沉淀量最小时,沉淀为Mg(OH)2,质量为11.6g,故到沉淀量最大,Al(OH)3的质量为19.4g-11.6g=7.8g,
由元素守恒可知,n(Al)=n[Al(OH)3],n(Mg)=n[Mg(OH)2],再利用m=nM计算Al、Mg的质量.
由元素守恒可知,n(Al)=n[Al(OH)3],n(Mg)=n[Mg(OH)2],再利用m=nM计算Al、Mg的质量.
解答:解:(1)Al与NaOH溶液反应生成偏铝酸钠和氢气,其离子方程式为:2Al+2OH-+2H2O=2NaAlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.继续滴加NaOH溶液,到沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者质量之和为19.4g,溶液为氯化钠溶液.再继续滴加NaOH溶液,到沉淀量开始进行,到沉淀量最小时,沉淀为Mg(OH)2,质量为11.6g,故到沉淀量最大,Al(OH)3的质量为19.4g-11.6g=7.8g,由元素守恒可知,n(Al)=n[Al(OH)3]=
=0.1mol,所以m(Al)=0.1mol×27g/mol=2.7g,n(Mg)=n[Mg(OH)2]=
=0.2mol,所以m(Mg)=0.2mol×24g/mol=4.8g,
故答案为:m(Mg)=4.8g,m(Al)=2.7g.
(2)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.继续滴加NaOH溶液,到沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者质量之和为19.4g,溶液为氯化钠溶液.再继续滴加NaOH溶液,到沉淀量开始进行,到沉淀量最小时,沉淀为Mg(OH)2,质量为11.6g,故到沉淀量最大,Al(OH)3的质量为19.4g-11.6g=7.8g,由元素守恒可知,n(Al)=n[Al(OH)3]=
| 7.8g |
| 78g/mol |
| 11.6g |
| 58g/mol |
故答案为:m(Mg)=4.8g,m(Al)=2.7g.
点评:本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,再利用守恒计算.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目