题目内容
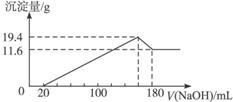
将一定质量的镁、铝合金,投入100 mL一定浓度的盐酸中,合金即溶解。向所得溶液中滴加5 mol·L-1NaOH溶液,生成的沉淀质量与加入NaOH溶液的体积如下图所示,由图中数据分析计算:
(1)原合金中镁的质量为__________g;
(2)铝的质量为__________g;
(3)盐酸的物质的量浓度为__________mol·L-1。
解析:Mg、Al合金在盐酸中发生化学反应的化学方程式为
①Mg+2HCl====MgCl2+H2↑
②2Al+6HCl====2AlCl3+3H2↑
由图可知,在上述溶液中有过量的盐酸,加入NaOH溶液后,发生的变化为
③HCl+NaOH====NaCl+H2O。
④MgCl2+2NaOH====Mg(OH)2↓+2NaCl。生成Mg(OH)2 11.6 g
⑤AlCl3+3NaOH====Al(OH)3↓+3NaCl。生成Al(OH)3 19.6 g-11.6 g=8 g
⑥Al(OH)3+NaOH====NaAlO2+2H2O。到此共用NaOH溶液180 mL
由化学方程式①和④可知,Mg、Al合金Mg与Mg(OH)2中Mg元素的质量相等。11.6 g Mg(OH)2中的Mg为4.8 g。
由化学方程式②和⑤可知,Mg、Al合金中Al与Al(OH)3中Al元素的质量相等。8 g Al(OH)3中Al的质量为2.8 g。
由化学方程式③—⑥可知,180 mL NaOH溶液里Na+最后对应于溶液里的NaCl和NaAlO2两种物质。
n(NaOH)=n(Na+)=0.18 L×5 mol·L-1=0.9 mol
n[Al(OH)3]=n(NaAlO2)=8 g÷78 g·mol-1=0.1 mol
则n(NaCl)=0.9 mol-0.1 mol=0.8 mol
由化学方程式③可知,n(HCl)=n(NaCl)=0.8 mol,
c(HCl)=0.8 mol÷0.1 L=8 mol·L-1。
答案:(1)4.8 (2)2.8 (3)8

 举一反三单元同步过关卷系列答案
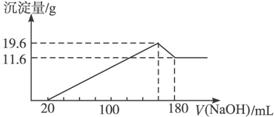
举一反三单元同步过关卷系列答案 将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积的关系如图,回答下列问题:
将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol?L-1NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液的体积的关系如图,回答下列问题: