题目内容
9.下列物质,按其晶体的熔点由高到低顺序排列正确的是( )| A. | SiO2 CsCl CBr4 CF4 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | CF4 CBr4 CsCl SiO2 |
分析 一般来说,晶体熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,分子晶体熔沸点与其相对分子质量成正比,且含有氢键的分子晶体熔沸点较高,据此判断.
解答 解:一般来说,晶体熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,分子晶体熔沸点与其相对分子质量成正比,且含有氢键的分子晶体熔沸点较高,SiO2、CsCl、CBr4、CF4分别是原子晶体、离子晶体、分子晶体、分子晶体,且相对分子质量CBr4>CF4,所以这几种晶体熔沸点高低顺序是SiO2、CsCl、CBr4、CF4,故选A.
点评 本题考查晶体熔沸点高低判断,为高频考点,明确晶体类型、分子晶体熔沸点影响因素等是解本题关键,知道常见物质晶体类型,题目难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
4.下列有机物中不属于醇类的是( )
| A. | 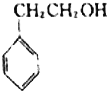 | B. | 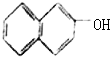 | C. |  | D. |  |
20.可逆反应:2NO2(g)?2NO(g)+O2(g),在容积固定的密闭容器中进行,下列事实不能说明达到平衡的是( )
| A. | 混合气体的颜色不再改变 | |
| B. | 混合气体的密度不再改变 | |
| C. | 混合气体的压强不再改变 | |
| D. | 混合气体的平均相对分子质量不再改变 |
17.硫代硫酸钠又名大苏打,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂.硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.装置如图所示
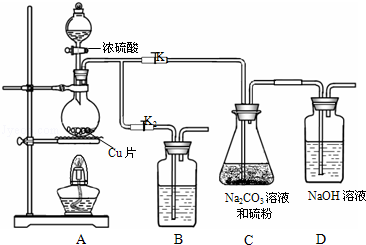
已知:Na2S2O3在酸性溶液中不能稳定存在.
(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下.
步骤1:如图连接后装置后,打开K1,关闭K2,将D中导管末端浸入水中,微热烧瓶观察气泡和水柱,检查装置A、C、D气密性;
步骤2:加入药品,打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热;
装置B中的药品可选用下列物质中的AC
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D饱和NaHSO3溶液
步骤3:C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时打开K2,关闭K1即停止C中的反应,停止加热.“当C中溶液的pH接近7时即停止C中的反应”的原因是S2O32-+2H+═S↓+H2O+SO2↑.(用离子方程式表示)
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品
(2)Na2S2O3性质的检验,向足量的新制氯水中滴加少量的Na2S2O3溶液,氯水颜色变浅,检查反应后的溶液中有硫酸根,写出该反应的离子方程式S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,得到混合溶液Vml,将其分成4等分,加入淀粉溶液作指示剂,用0.010mol•L-1的Na2S2O3溶液进行滴定,相关数据如表所示
部分反应的离子方程式为:①Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;②I2+2S2O32-═S4O62-+2I-
判断达到滴定终点的现象是当滴入最后一滴Na2S2O3时,溶液蓝色消失且半分钟不变色.
废水中Ba2+的物质的量浓度为0.0024mol/L.

已知:Na2S2O3在酸性溶液中不能稳定存在.
(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下.
步骤1:如图连接后装置后,打开K1,关闭K2,将D中导管末端浸入水中,微热烧瓶观察气泡和水柱,检查装置A、C、D气密性;
步骤2:加入药品,打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热;
装置B中的药品可选用下列物质中的AC
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D饱和NaHSO3溶液
步骤3:C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时打开K2,关闭K1即停止C中的反应,停止加热.“当C中溶液的pH接近7时即停止C中的反应”的原因是S2O32-+2H+═S↓+H2O+SO2↑.(用离子方程式表示)
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品
(2)Na2S2O3性质的检验,向足量的新制氯水中滴加少量的Na2S2O3溶液,氯水颜色变浅,检查反应后的溶液中有硫酸根,写出该反应的离子方程式S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,得到混合溶液Vml,将其分成4等分,加入淀粉溶液作指示剂,用0.010mol•L-1的Na2S2O3溶液进行滴定,相关数据如表所示
| 编 号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
判断达到滴定终点的现象是当滴入最后一滴Na2S2O3时,溶液蓝色消失且半分钟不变色.
废水中Ba2+的物质的量浓度为0.0024mol/L.
14.NA为阿伏伽德罗常数值下列说法正确的是( )
| A. | 30g丙醇中存在的共价键总数为5NA | |
| B. | 密闭容器中2mol NO与1mol O2充分反应,转移的电子数为2NA | |
| C. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子总数为2NA | |
| D. | 2.8g乙烯和环丁烷(C4H8)的混合气体中含有的原子总数为0.6NA |
1.下列变化一定要加入还原剂才能实现的是( )
| A. | KMnO4→K2MnO4 | B. | HCl→Cl2 | C. | Fe3+→Fe2+ | D. | Na2O→NaOH |
18.亚硝酸盐中毒,又名乌鸦病,久置的韩国泡菜常含亚硝酸盐.亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象.新鲜水果蔬菜富含的维生素C是亚硝酸盐中毒的有效解毒剂.下列说法中,不正确的是( )
| A. | 在中毒过程中血红蛋白被氧化 | B. | 解毒时血红蛋白被还原 | ||
| C. | 维生素C应具有还原性 | D. | 中毒时亚硝酸盐发生氧化反应 |
19.下列各组离子在强酸性的溶液中能大量共存,且溶液无色透明的是( )
| A. | Cu2+、Cl-、K+、SO42- | B. | CO32-、Na+、K+、SO42- | ||
| C. | Mg2+、Cl-、K+、NO3- | D. | Ag+、NO3-、K+、Cl- |