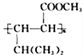题目内容
【题目】氨基甲酸铵(NH2COONH4)是重要的氨化剂,分解温度40℃,遇水水解为碳酸氢铵。某研究小组欲探究NH2COONH4的制备与性质。
Ⅰ.实验室制备NH2COONH4
反应原理:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0。

(1)装置A中发生的化学反应方程式为__________________________________。
(2)上述装置的连接顺序为A→_____→_____→______;D装置所盛放的试剂为__________,C中三角漏斗的作用是________________________。
Ⅱ.制备实验的改进
(3)有人提出利用下列装置代替聚氯乙烯薄膜反应器。

该装置的优点是_______________、________________。结合化学反应方程式解释不能用水代替CCl4的原因是________________;当大量固体物质悬浮于CCl4上时即可停止反应,分离出产品的方法是______________。
Ⅲ.对NH2COONH4产物成分的探究
(4)已知,制备过程中因温度控制不当,在150℃时会产生尿素。如果对参加反应的气体干燥不彻底可能会有NH4HCO3、(NH4)2CO3杂质生成。
①请设计简单实验方案探究上述产物中是否有尿素_______________________。
②请设计定量实验方案探究上述产物(假设不存在NH4HCO3)中是否有碳酸铵___________________。
(以上方案均不需详细描述实验步骤,限用试剂:蒸馏水、Ba(OH)2溶液;仪器自选)
【答案】 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O↑ D B C 碱石灰 防倒吸 通过冰水浴及时降温促进平衡正向移动以提高产率 便于观察NH3、CO2的混合比例(或易于NH3和CO2的充分混合) NH2COONH4+2H2O=NH4HCO3+NH3·H2O 过滤 将产物取样加热到40 ℃让其分解,如果有固体剩余则含尿素 取一定质量样品用蒸馏水溶解后,加入足量Ba(OH)2溶液,测量单位质量的样品所产生沉淀的质量,如果每克样品产生沉淀小于
CaCl2+2NH3↑+2H2O↑ D B C 碱石灰 防倒吸 通过冰水浴及时降温促进平衡正向移动以提高产率 便于观察NH3、CO2的混合比例(或易于NH3和CO2的充分混合) NH2COONH4+2H2O=NH4HCO3+NH3·H2O 过滤 将产物取样加热到40 ℃让其分解,如果有固体剩余则含尿素 取一定质量样品用蒸馏水溶解后,加入足量Ba(OH)2溶液,测量单位质量的样品所产生沉淀的质量,如果每克样品产生沉淀小于![]() g,则含(NH4)2CO3
g,则含(NH4)2CO3
【解析】Ⅰ.(1)根据制备的原理可知,利用装置A来制备氨气,可以用氯化铵和熟石灰混合加热,反应方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O↑;正确答案:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O↑;正确答案:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O↑。
CaCl2+2NH3↑+2H2O↑。
(2)利用A装置制备氨气,利用D装置干燥氨气,然后氨气进入到B装置进行反应,多余的氨气进行吸收(C),因此上述装置的连接顺序为A→D→B→C;氨气中混有水蒸气,可用碱石灰来干燥,D装置所盛放的试剂为碱石灰;C中三角漏斗的作用是防倒吸;正确答案:D 、B、C;碱石灰;防倒吸。
Ⅱ.(3)改进后的装置的优点是通过冰水浴及时降温促进平衡正向移动以提高产率,易于NH3和CO2的充分混合,加快反应速率;根据题给信息可知,氨基甲酸铵遇水水解为碳酸氢铵,所以不能用水代替CCl4,反应的方程式:NH2COONH4+2H2O=NH4HCO3+NH3·H2O;固液分离可以用过滤的方法进行分离;正确答案:通过冰水浴及时降温促进平衡正向移动以提高产率;便于观察NH3、CO2的混合比例(或易于NH3和CO2的充分混合); NH2COONH4+2H2O=NH4HCO3+NH3·H2O;过滤。
Ⅲ.(4)①碳酸氢铵、碳酸铵受热分解为氨气和水,不再有固体剩余,若是有尿素存在,最终有固体剩余;因此可以采用将产物取样加热到40 ℃让其分解,如果有固体剩余则含尿素;正确答案:将产物取样加热到40 ℃让其分解,如果有固体剩余则含尿素。
②利用碳酸盐与足量的氢氧化钡溶液反应产生碳酸钡沉淀的质量的情况进行定量判断,具体操作如下:取一定质量样品用蒸馏水溶解后,加入足量Ba(OH)2溶液,测量单位质量的样品所产生沉淀的质量,如果每克样品产生沉淀小于![]() g,则含(NH4)2CO3;正确答案:取一定质量样品用蒸馏水溶解后,加入足量Ba(OH)2溶液,测量单位质量的样品所产生沉淀的质量,如果每克样品产生沉淀小于
g,则含(NH4)2CO3;正确答案:取一定质量样品用蒸馏水溶解后,加入足量Ba(OH)2溶液,测量单位质量的样品所产生沉淀的质量,如果每克样品产生沉淀小于![]() g,则含(NH4)2CO3。
g,则含(NH4)2CO3。

 天天向上口算本系列答案
天天向上口算本系列答案