题目内容
17.海洋是巨大的化学资源宝库.下面是海水化学资源综合利用的部分流程图:
回答:(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、Na2CO3 (填试剂化学式),然后过滤(填操作名称).在溶液中再加适量盐酸或HCl(填试剂),加热蒸干溶液即得到精盐.
(2)某同学在实验室模拟氯碱工业的生产原理电解饱和食盐水.用玻璃棒蘸浓氨水检验阳极产生的气体,发现产生大量白烟.阳极生成的气体是Cl2或氯气,白烟的主要成分是NH4Cl.
(3)制取MgCl2的过程中涉及反应:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2+6H2O,该反应要在HCl气流中进行,原因是MgCl2容易水解,MgCl2+2H2O?Mg(OH)2+2HCl,在HCl 气流中,可以抑制MgCl2水解,同时带走水分.
(4)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的.由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是SO2>Br->Cl-
(5)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时有CO2放出.最后再用H2SO4处理得到Br2,最后一步反应的离子方程式是5Br-+BrO3-+6H+=3Br2+3H2O.
分析 海水晒盐得到氯化钠溶液和卤水,氯化钠溶液电解得到氢氧化钠溶液、氢气和氯气,氢气和氯气反应生成氯化氢气体,氯化氢溶于水得到盐酸,卤水中加入氧化钙沉淀镁离子生成氢氧化镁沉淀,过滤得到沉淀中加入盐酸溶解得到氯化镁溶液,蒸发浓缩,冷却结晶,过滤得到氯化镁晶体,在氯化氢气体中加热失去结晶水得到固体氯化镁,卤水中通入氯气,氧化溴离子为溴单质,被二氧化硫吸收生成溴化氢,富集溴元素后再通入氯气氧化溴离子为溴单质,
(1)根据镁离子会与氢氧根离子、碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,过滤后加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析;粗盐中的镁离子可以加入氢氧化钠来除去;加Na2CO3溶液既可以除去溶液中的钙离子还可以出去溶液中多余的钡离子;
(2)依据电解饱和食盐水阳极是氯离子是失电子发生氧化反应生成氯气;氯气可以氧化氨气生成氯化氢遇到氨气生成的氯化铵固体;
(3)抑制镁离子水解生成氢氧化镁沉淀;
(4)依据氧化还原反应中还原剂的还原性大于还原产物,结合反应过程中的离子方程式分析判断;
(5)生成溴化钠和溴酸钠,在酸溶液中会反应归中反应.
解答 解:(1)镁离子会与氢氧根离子、碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,过滤后加入盐酸可以除去过量的碳酸钠和氢氧化钠,需要依次加入稍过量的NaOH、BaCl2 、Na2CO3、过滤、在滤液中加入盐酸至不再有气体生成,将所得溶液加热浓缩、冷却结晶,得到精盐,
故答案为:Na2CO3;过滤;盐酸或HCl;
(2)在实验室模拟氯碱工业的生产原理电解饱和食盐水.用玻璃棒蘸浓氨水检验阳极产生的气体,解饱和食盐水阳极是氯离子是失电子发生氧化反应生成氯气;氯气可以氧化氨气生成氯化氢遇到氨气生成的氯化铵固体,
故答案为:Cl2或氯气;NH4Cl;
(3)MgCl2容易水解生成氢氧化镁沉淀,MgCl2+2H2O?Mg(OH)2+2HCl,在HCl 气流中,可以抑制MgCl2水解,同时带走水分;
故答案为:MgCl2容易水解,MgCl2+2H2O?Mg(OH)2+2HCl,在HCl 气流中,可以抑制MgCl2水解,同时带走水分;
(4)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的.由海水提溴过程中的反应中还原剂的还原性大于还原产物,2Br-+Cl2=Br2+2Cl-;反应中还原剂Br-的还原性大于还原产物Cl-;Br2+SO2+2H2O=H2SO4+2HBr;反应中还原剂SO2的还原性大于还原产物Br-;可得出Cl-、SO2、Br-还原性由强到弱的顺序是SO2>Br->Cl-,故答案为:SO2>Br->Cl-;
(5)生成溴化钠和溴酸钠,最后再用H2SO4处理得到Br2,说明溴离子和溴酸根离子在酸溶液中发生氧化还原反应生成溴单质,反应的离子方程式为:5Br-+BrO3-+6H+=3Br2+3H2O;
故答案为:5Br-+BrO3-+6H+=3Br2+3H2O.
点评 本题考查了离子性质的应用,混合物除杂的实验方案分析,氧化还原反应的强弱规律应用,归中反应的分析判断,离子方程式的书写方法,题目难度中等.

 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).(1)用A、B、O表示这类特殊晶体的化学式ABO3.在图中,与A原子配位的氧原子数目为12.
(2)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其中电子的运动状态有24种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为3:2.
(4)下表是几种碳酸盐的热分解温度和阳离子半径
| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数.对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为a pm,阿伏加德罗常数的值为NA,金属钙的密度为$\frac{1.6×1{0}^{32}}{{N}_{A}•{a}^{3}}$g•cm-3(用含a和NA的式子表示).
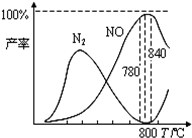 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下①主反应和
②副反应:
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ/mol
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol
有关物质产率与温度的关系如图.下列说法正确的是( )
| A. | 加压可提高NH3生成NO的转化率 | |
| B. | 工业上氨催化氧化生成 NO时,反应温度最好控制在780℃以下 | |
| C. | 达到平衡后,保持其它条件不变,再充入2 mol O2反应①的平衡常数K保持不变 | |
| D. | N2氧化为NO的热化学方程式为:N2(g)+O2(g)?2NO(g)△H=+363 kJ/mol |

 新修改的《机动车驾驶证申领和使用规定》于2010年4月1日起实施,新规规定酒驾一次扣12分,出此拳治理酒驾是因酒后驾车是引发交通事故的重要原因.如图所示为交警在对驾驶员是否饮酒进行检测.其原理是:橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+.下列对乙醇的描述与此测定原理有关的是( )
新修改的《机动车驾驶证申领和使用规定》于2010年4月1日起实施,新规规定酒驾一次扣12分,出此拳治理酒驾是因酒后驾车是引发交通事故的重要原因.如图所示为交警在对驾驶员是否饮酒进行检测.其原理是:橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+.下列对乙醇的描述与此测定原理有关的是( )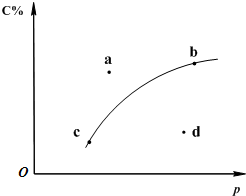 对于可逆反应2A(?)+B(g)?2C(g);如图是其它条件一定时反应中C的百分含量与压强的关系曲线.回答下列问题:
对于可逆反应2A(?)+B(g)?2C(g);如图是其它条件一定时反应中C的百分含量与压强的关系曲线.回答下列问题: .(在答题纸上标)
.(在答题纸上标)