题目内容
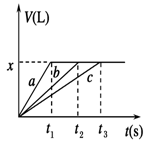
将2molNaHCO3和一定量的Na2O2固体混合,在加热的条件下使其反应,经测定无Na2O2剩余,则最后所得固体的物质的量(n)为
| A.1mol<n≤2mol | B.1mol<n≤4mol |
| C.2mol<n≤4mol | D.n>4mol |
B
试题分析:采用极限的思路解决该题,若固体只有NaHCO3,则剩余固体为碳酸钠,物质的量为1mol;若过氧化钠恰好与NaHCO3分解产物反应,2molNaHCO3分解产生1mol二氧化碳和1mol水共消耗Na2O22mol,故剩余固体为碳酸钠2mol,氢氧化钠2mol,共为4mol。答案为B。

练习册系列答案
相关题目