题目内容
将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol/L的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是
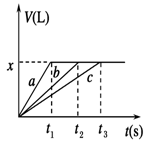

| A.x=2.24 |
| B.钠的物质的量为0.2 mol |
| C.反应时,Na、Mg、Al均过量 |
| D.曲线b为Mg与盐酸反应的图像 |
C
试题分析:钠是活泼的金属,极易与水反应,因此钠与盐酸的反应速率最快,而镁或铝与水不反应,只能与盐酸反应,因此a表示钠,b表示Mg,c表示Al。根据图像可知,反应中生成的氢气体积相同,所以参加反应的盐酸是相同,即金属再与盐酸反应时盐酸不足,金属过量。但过量的金属钠会继续与水反应放出氢气,所以根据方程式2Na+2HCl=2NaCl+H2↑可知钠的物质的量只能是0.1L×2mol/L=0.2mol,则镁和铝的物质的量也是0.2mol。氢气的物质的量是0.2mol÷2=0.1mol,标准状况下的体积是2.24L,即选项A、B、D正确,C不正确,所以答案选C。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
