题目内容
把100mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的
| A.硫酸铜溶液 | B.硝酸钠溶液 | C.醋酸钠溶液 | D.氢氧化钠溶液 |
C
解析试题分析:A、加入适量的硫酸铜溶液,锌与硫酸铜发生反应生成Cu与Zn形成原电池,加快反应速率,错误;B、加入硝酸钠后溶液中相当于有了硝酸,与锌反应不会生成氢气,氢气的量减少,错误;C、加入醋酸钠后溶液在有醋酸生成,醋酸是弱酸,氢离子浓度减小,氢离子的物质的量不变,反应速率减慢,且不影响氢气的总量,正确;D、加入氢氧化钠溶液,与硫酸反应消耗氢离子,使产生的氢气减少,错误,答案选C。
考点:考查条件对反应速率的影响判断

某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。 
(1)能说明有SO2气体产生的实验现象是 。
(2)图2中导气管e的主要作用为 。
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:
。
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是 。
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+; Ⅲ:既有Fe3+又有Fe2+。
为确认溶液的成分,选用如下试剂:
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
试完成下列相关的实验探究:
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1) ,则说明Ⅱ成立。 (2) ,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立。 |
| 2、 | 。 |
CuSO4是一种重要的化工原料,有关制备途径及性质如下图所示。下列说法错误的是( )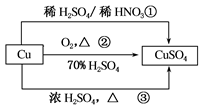
| A.途径①所用混酸中H2SO4与HNO3的最佳物质的量之比为3:2 |
| B.与途径①、③相比,途径②更好地体现了绿色化学思想 |
| C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量①=②<③ |
| D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol |
氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是
| A.HI和HClO | B.HCl和HIO |
| C.HClO3和HIO | D.HClO和HIO |
古代器物上的颜料至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确的是
| A.用盐的形式表示: BaSiO3·CuSiO3 | B.用氧化物形式表示:BaO·CuO·2SiO2 |
| C.易溶于强酸、强碱 | D.性质稳定,不易褪色 |
下列酸在与金属发生反应时,其中硫或氮元素的化合价不会发生变化的是( )
| A.稀硫酸 | B.稀硝酸 | C.浓硫酸 | D.浓硝酸 |
下列关于碳族元素的说法中,错误的是
| A.它们从上到下的非金属性向金属性递变的趋势比卤族元素明显 |
| B.碳族元素的气态氢化物的稳定性从上到下逐渐减弱 |
| C.碳族元素原子的最外层都有4个电子 |
| D.主要化合价有+2价和+4价,大多数+2价化合物稳定 |
下列叙述错误的是
| A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
| B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
| C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 |
| D.用AgNO3溶液可以鉴别KC1和KI |

 2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。