��Ŀ����
4��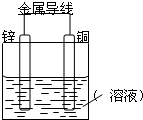 ��Zn����Cu���õ������Ӻ���ij�������Һ�У�������ͼ��ʾװ�ã��Իش��������⣺
��Zn����Cu���õ������Ӻ���ij�������Һ�У�������ͼ��ʾװ�ã��Իش��������⣺�����������ҺΪϡ���ᣬ
��1��Zn��Ϊԭ��صĸ���������缫��ӦʽΪZn-2e-=Zn2+��
��2��Cu��Ϊԭ��ص�����������缫��ӦʽΪ2H++2e-=H2����
���������Ϊ����ͭ��Һ��
��3��Cu���Ϸ�����ԭ��Ӧ��Ӧ��
��4�������������������У�ת�Ƶ�������ȣ���Cu���Ϣ�͢����������ʵ�����֮��Ϊ1��1��
���� ��1��ͭпԭ����У����ý�������������пΪ������������пʧȥ��������п���ӣ�
��2��ͭΪ������ͭ���������ӵõ���������������
��3����Ϊ����ͭ��Һ��ͭ����ͭ���ӵõ���������ͭ��������ԭ��Ӧ��
��4������ԭ��������ϵ�ʧ������Ŀ��ȼ�������������ͭ�����ʵ�����
��� �⣺��1����Zn����Cu���õ������Ӻ����������ҺΪϡ���ᣬ��пΪ������ͭΪ������������ӦΪ��Zn-2e-=Zn2+��
�ʴ�Ϊ������Zn-2e-=Zn2+��
��2�������������ӵõ����������������缫��ӦʽΪ��2H++2e-=H2����
�ʴ�Ϊ��������2H++2e-=H2����
��3����Zn����Cu���õ������Ӻ��������Ϊ����ͭ��Һ����������������ͭ��пΪ������������ӦΪZn-2e-=Zn2+��������ӦΪ��Cu2++2e-=Cu�����������˻�ԭ��Ӧ��
�ʴ�Ϊ����ԭ��Cu2++2e-=Cu��
��4�������������������У�ת�Ƶ�������ȣ���Ϊ1mol���ӣ���Cu���ϣ������������ʵ����ʵ���Ϊ��$\frac{1mol}{2}$=0.5mol���������������ʵ����ʵ���Ϊ��$\frac{1mol}{2}$=0.5mol��Cu���ϣ��ͣ������������ʵ����ʵ�����ȣ������ʵ���֮��Ϊ1��1��
�ʴ�Ϊ��1��1��
���� ���⿼��ԭ��صĹ���ԭ������Ӧ�ã���Ŀ�Ѷ��еȣ���ȷԭ��ع���ԭ��Ϊ���ؼ���ע�����յ缫���жϺ͵�ⷴӦʽ����д������

 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д� ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д�| A�� | �����ǡ����ȫ��Ӧ�������ε���Һ | |
| B�� | pH=7����Һ | |
| C�� | ʹʯ����Һ����ɫ����Һ | |
| D�� | c��H+��=c��OH-��=10-6mol•L-1����Һ |
| A�� | ������Ϊ198 | B�� | ������Ϊ140 | C�� | ������Ϊ82 | D�� | ���������Ϊ58 |
| A�� | 3 | B�� | 4 | C�� | 5 | D�� | 6 |
| ���������� | ���� | |
| A | ����С��ͬ��K��Na����������ˮ�У��ر��Ʒ�Ӧ���� | ��Ԫ�صĽ����Ա���Ԫ��ǿ |
| B | ��Ba��OH��2•8H2O��NH4Cl������С�ձ��л�ϣ����ִ����ձ���ڸо����� | Ba��OH��2•8H2O��NH4Cl�ķ�Ӧ�����ȷ�Ӧ |
| C | ��ʢ��H2O2��Һ���Թ��У���������FeCl3��Һ���������ݵ����ʱȲ���FeCl3��Һ�Ŀ� | FeCl3���Լӿ�H2O2�ֽ�����ʣ����˴����� |
| D | ������KMnO4��Һ��ͨ��SO2���壬KMnO4��Һ��ɫ��ȥ�� | SO2����Ư���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
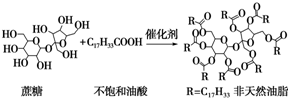
| A�� | ������������֬������ | |
| B�� | �÷���Ȼ��֬Ϊ�߷��ӻ����� | |
| C�� | �÷���Ȼ��֬������������Һ���ȣ���ˮ����ﲻ����ˮ��Ӧ | |
| D�� | ����������ϡ�����������ˮ�⣬���տ����������л������� |

����˵����ȷ���ǣ�������
| A�� | ��ŵ��������ֻ��һ�ֹ����� | |
| B�� | ���ַ�Ӧ�������NaHCO3��Һ��Ӧ�ų�CO2 | |
| C�� | ����FeCl3��Һ��������ˮ����Ͷ����������� | |
| D�� | ��ŵ��������NaOH��Һ���ȣ��������������� |
| A�� | �������ӣ�����ˮ������ | |
| B�� | �������������ᣩ���Ҵ���Ũ���ᣬ�������� | |
| C�� | �Ҵ���ˮ������ˮ�Ȼ��ƣ���Һ | |
| D�� | ��Ȳ��H2S��PH3��������ͭ��Һ��ϴ�� |
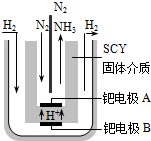 �ϳɰ���ҵ�����Ṥҵ�Թ���ũ��������������Ҫ���壮��ش�
�ϳɰ���ҵ�����Ṥҵ�Թ���ũ��������������Ҫ���壮��ش�