题目内容
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示,根据判断出的元素回答问题:
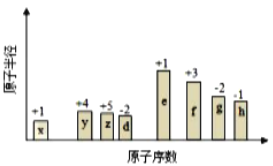
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式____________________。
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如图所示:
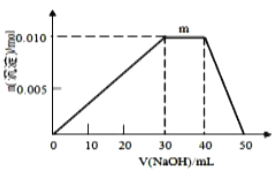
①R中存在的化学键有________________。
②写出m点反应的而离子方程式________________________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后产生沉淀的物质的量为_______mol。
【答案】第三周期ⅢA族 r(O2-) r(Na+) HClO4 H2SO4 ![]() 离子键 共价键 NH4+ + OH-=NH3·H2O 0.022
离子键 共价键 NH4+ + OH-=NH3·H2O 0.022
【解析】
x的原子序数最小,原子半径也最小,且最高正化合价为+1价,则X是H,e的最高正化合价为+1价,原子半径最大,则e是Na,y的原子序数比e小,最高正价为+4价,则y是C,z的原子序数略大于y,最高正化合价为+5价,则z是N,d是O,f原子序数比钠大,最高正化合价为+3价,则f是Al,g的最低负化合价为-2价,原子序数比铝大,则g是S,h最低负价为-1价,原子序数大于硫,则h是Cl,由此分析解答。
从图中的化合价、原子半径的大小及原子序数,可以知道x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,则
(1)f是Al元素,原子核外有3个电子层,最外层电子数为3,在元素周期表的位置是第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2-)>r(Na+);非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4;
(3)x与z形成四原子共价化合物为NH3,电子式为![]() ;
;
(4)①R是NH4Al(SO4)2,其中存在离子键和共价键。
②m点处,沉淀的物质的量不变,发生反应为:铵根离子和氢氧根离子反应成一水合氨,其离子方程式为NH4++OH-=NH3·H2O。
③20mL1.2 mol·L-1Ba(OH)2溶液含有0.048molOH-和0.024molBa2+,10mL1mol·L-1R溶液中含有0.01molNH4+、0.01molAl3+和0.02molSO42-。根据NH4++OH-=NH3·H2O、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O、Ba2++SO42-=BaSO4↓可知当0.048molOH-完全反应完时,还有0.002molAl(OH)3未溶解,0.02molSO42-与钡离子反应生成0.02mol硫酸钡沉淀,所以最后沉淀的物质的量为0.022mol。

 科学实验活动册系列答案
科学实验活动册系列答案